Destruição da Camada de Ozônio
A camada de ozônio tem o importante papel de nos proteger de raios UV, mas ela vem sendo destruída pelos gases CFCs.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
A camada de ozônio (O3(g)) fica distribuída na parte média e baixa da região da atmosfera denominada de estratosfera, que está situada numa altitude entre 20 km e 35 km da superfície do planeta.
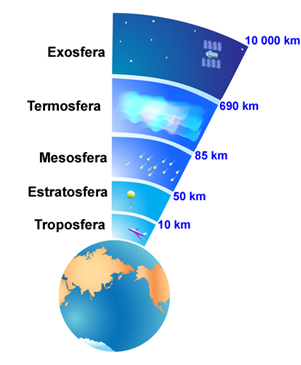
Camadas da atmosfera
O ozônio é formado quando a radiação solar decompõe as moléculas do gás oxigênio (O2(g)), liberando oxigênio livre na atmosfera. Posteriormente, esse oxigênio livre reage com o gás oxigênio e forma o ozônio, conforme as reações abaixo:
1ª etapa: O2(g) → 2 O(g)
2ª etapa: O(g) + O2(g) → 1 O3(g)
O nome dessa substância vem do grego ózo que significa “cheiro”, isso porque o ozônio tem um odor bastante forte. Inclusive, a sua descoberta se deu em 1840 porque o químico alemão Christian Friedrich Schönbein (1799-1868) sentiu um cheiro estranho no laboratório em que trabalhava e viu que se tratava de uma nova substância, o ozônio.
A camada de ozônio é de extrema importância para a vida no planeta, pois ela atua como um “cobertor protetor” que absorve grande parte da radiação ultravioleta (UV) do Sol e impede que a maior parte dela atinja a superfície da Terra. Os raios UV são os que causam o bronzeamento da pele, mas eles são perigosos porque podem danificar o nosso DNA (ácido desoxirribonucleico) e causar mutações genéticas, com danos inimagináveis.
No entanto, na década de 1970, os cientistas passaram a estudar a degradação que estava ocorrendo em nossa camada de ozônio e descobriram que isso estava acontecendo devido à injeção de gases na atmosfera pelo próprio ser humano. Em 1974, o radioquímico americano F. Sherwood Rowland e o químico mexicano Mario Molina descobriram, por meio de experimentos bastante cuidadosos, que os maiores causadores da destruição da camada de ozônio eram os gases chamados de CFCs (Clorofluorcarbonetos, também conhecidos como Fréons®).
Como o próprio nome indica, os CFCs são compostos de átomos de carbono, flúor e cloro. Eles são formados por moléculas do tipo metano (CH4) e etano (H3C ? CH3), em que seus átomos de hidrogênio são substituídos por átomos de cloro e flúor. Os principais CFC’s são CCl3F (nome comercial CFC-11), CCl2F2 (CFC-12), CClF2CClF2 (CFC-114) e CClF2CF3 (CFC-115).
Os CFCs eram produzidos principalmente para serem usados em compressores para refrigeração doméstica (por exemplo, em geladeiras), para expansão de polímeros e em produtos do tipo spray.

Os CFCs são produzidos principalmente para serem usados em produtos do tipo spray e em compressores para refrigeração doméstica
Quando os CFCs atingem a estratosfera, a luz solar fotoliza essas moléculas, liberando átomos de cloro. Veja como isso ocorre, tomando como exemplo o CH3Cl:
CH3Cl(g) → CH3(g) + Cl(g)
Esse átomo de cloro reage com as moléculas de ozônio, diminuindo a sua concentração na atmosfera e causando a destruição da camada de ozônio:
Cl(g) + O3(g) → ClO(g) + O2(g)
Existem vários fatores agravantes dessa situação, um deles é que o gás oxigênio que já existe na atmosfera, bem como o que foi produzido nesta última reação, também reage com o ozônio, degradando-o e liberando ainda mais oxigênio:
O2(g) + O3(g) → O2(g) + O2(g)
Outro agravante é que o ClO(g) formado na degradação do ozônio pelo cloro também reage com os átomos de oxigênio livres na atmosfera e liberam mais átomos de cloro e de gás oxigênio, que continuarão degradando o ozônio da estratosfera:
ClO(g) + O(g) → Cl(g) + O2(g)
Para se ter uma ideia, um átomo de cloro liberado tem a capacidade de destruir cerca de 100 mil moléculas de ozônio! E para piorar ainda mais esse fato, o tempo médio de residência na atmosfera varia de 75 anos (CFC-11) até 380 anos (CFC-115).
O resultado de tudo isso foi visto em 1985, quando cientistas do Levantamento Antártico Britânico relataram que, desde o final da década de 70, a camada de ozônio sobre a Antártida vinha sendo destruída. O “buraco” na camada de ozônio sobre a Antártida atingiu um recorde em 2000, quando abrangeu 28,6 milhões de km2 (mancha azul na imagem abaixo).
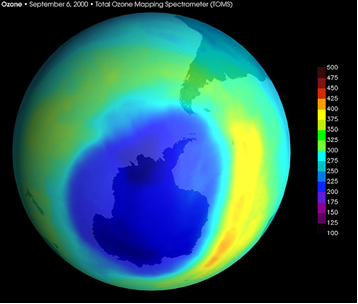
Imagem tirada por satélite da Nasa de “buraco” na camada de ozônio sobre a Antártida, em setembro de 2000
A produção, uso e emissão desses gases diminuíram bastante desde 1987, em decorrência do Tratado de Montreal sobre Substâncias que Destroem a Camada de Ozônio e suas revisões posteriores, em que os maiores produtores de CFCs do mundo prometeram a substituição gradativa dessas substâncias por outras que sejam mais inofensivas à camada de ozônio.
Entre as substâncias usadas estão os hidroclorofluorcarbonetos que se diferem dos CFCs apenas por um ou mais átomos de cloro e/ou flúor serem substituídos por átomos de hidrogênio. A presença do hidrogênio torna a molécula mais instável, degradando-se antes de atingir a estratosfera. Porém, esses compostos ainda não são a solução do problema porque eles também são potentes gases-estufa.
Por Jennifer Fogaça
Graduada em Química




