Oxidorredução
Oxidorredução é uma reação química em que há transferência de elétrons entre duas espécies. A espécie que doa elétrons é oxidada, e a espécie que recebe elétrons é reduzida.
Por Ana Luiza Lorenzen Lima

PUBLICIDADE
Oxidorredução é um tipo de reação química que ocorre mediante a transferência de elétrons entre duas espécies distintas. Esse processo também é chamado de oxirredução ou redox. Na oxidorredução, a espécie que doa elétrons sofre uma reação de oxidação e é o agente redutor. Simultaneamente, outra espécie recebe elétrons, sofrendo uma reação de redução: o agente oxidante.
Um átomo, elemento ou molécula apenas doa elétrons se houver outra espécie para recebê-los, portanto as reações de oxidação e redução sempre ocorrem paralelamente e são chamadas de semirreações. A combinação entre as duas semirreações forma a reação global para o processo redox. Reações de oxidorredução são muito comuns. Alguns exemplos são a respiração, a fotossíntese, a combustão, a corrosão e a geração de energia por pilhas e baterias.
Leia também: Ligações químicas — as ligações feitas por átomos para terem maior estabilidade
Resumo sobre oxidorredução
-
Oxidorredução é uma reação química em que há transferência de elétrons entre espécies.
-
A espécie que doa elétrons sofre oxidação e é o agente redutor.
-
A espécie que recebe elétrons sofre redução e é o agente oxidante.
-
Semirreações de redução e de oxidação ocorrem simultaneamente.
-
Fotossíntese, respiração e combustão são apenas alguns dos vários exemplos de reações de oxidorredução do cotidiano.
O que é a oxidorredução?
A oxidorredução é um tipo de reação química que ocorre mediante a transferência de elétrons entre duas espécies químicas. Na oxidorredução, um dos reagentes é capaz de doar um ou mais de seus elétrons, sofrendo uma reação de oxidação, enquanto a outra espécie recebe esses elétrons, passando por uma reação de redução.
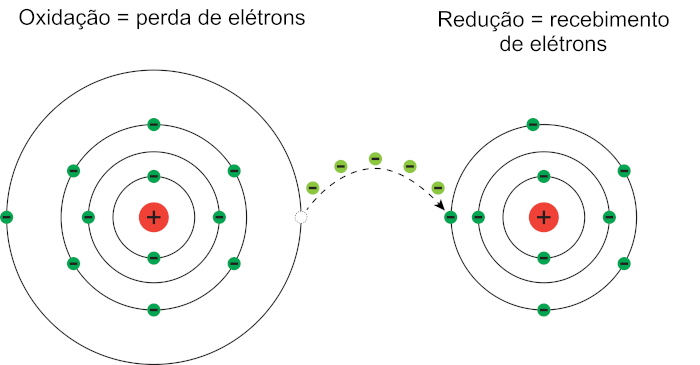
Como trata-se de um processo de transferência, uma das espécies doa os elétrons, e, obrigatoriamente, deve existir outra espécie que vai recebê-los. Assim, a oxidorredução é constituída por uma reação de oxidação e uma reação de redução, que ocorrem simultaneamente e são complementares.
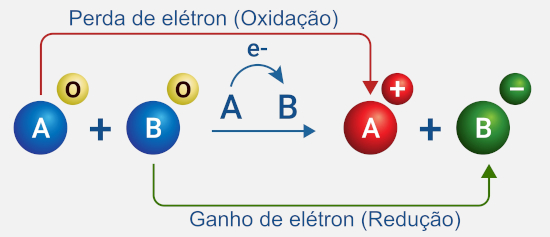
Essas reações podem ocorrer de forma espontânea ou não espontânea. O que define isso são os valores de potenciais padrão de redução dos elementos envolvidos.
Importante: Oxidorredução, oxirredução ou reações redox são palavras sinônimas para descrever esse processo.
Como a oxidorredução ocorre?
A oxidorredução se dá pela ocorrência de duas reações químicas paralelas, nomeadas como semirreações. Afinal, não existe transferência de elétrons sem que uma espécie receba os elétrons doados de outra.
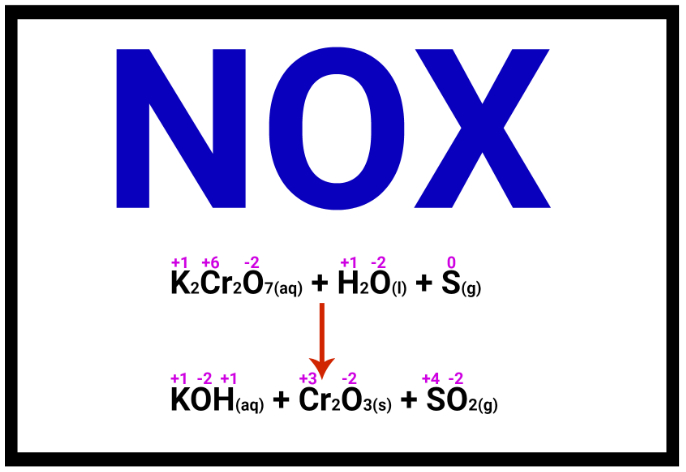
Processos de oxidorredução são identificados pela alteração do número de oxidação (Nox) das espécies envolvidas.
Semirreação de oxidação: há a doação ou perda de um ou mais elétrons. Isso é identificado pela elevação do Nox da espécie envolvida, em razão da saída de espécies de carga elétrica negativa.
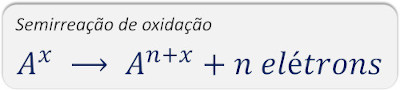
Exemplos:
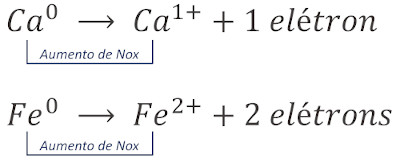
Pereba que o cálcio (Ca) e o ferro (Fe) se tornaram mais positivos em decorrência da transferência de elétrons.
Semirreação de redução: há o recebimento dos elétrons doados, processo identificado pela redução do Nox, uma vez que essas espécies se tornam “mais negativas”.

Exemplos:

Note que a prata (Ag) e o zinco (Zn) se tornam mais negativos, pois estão acomodando os elétrons transferidos em sua eletrosfera.
Apesar de a oxidorredução ser expressa como duas semirreações separadas, essas duas semirreações ocorrem simultaneamente e compõem um único processo químico. A representação em semirreações é uma forma didática para o entendimento de um processo redox.
Por meio da combinação entre as semirreações, é obtida a reação química global do processo, como representado abaixo.
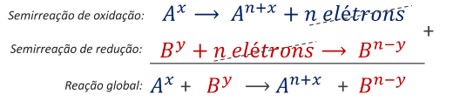
Note que na reação química global não aparecem “elétrons”. A transferência de elétrons está implícita na variação do Nox das espécies envolvidas.
A espécie que é oxidada é denominada agente redutor da reação redox, uma vez que ao se oxidar ela causa a redução do outro reagente. Seguindo o raciocínio, a espécie que é reduzida é o agente oxidante da reação redox, pois promove a oxidação do outro reagente.
→ Exemplo de como ocorre a oxidorredução
Vejamos um exemplo de como ocorre a oxidorredução. Um fio de cobre metálico (Cu0) é imerso em uma solução de íons prata (Ag+), e uma reação espontânea se inicia em poucos minutos. Ao redor do fio de cobre surgem pequenos grânulos, os quais crescem formando uma camada rugosa, que é a prata metálica.

Quando o fio de cobre entra em contato com a solução de íons prata, imediatamente se inicia o processo de transferência de elétrons do cobre metálico para os íons prata em solução. O cobre metálico é oxidado, de acordo com a semirreação de oxidação abaixo, e tem seu Nox aumentado. O cobre é o agente redutor do processo (pois promove a redução da prata).
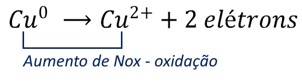
Simultaneamente, os íons prata recebem elétrons sendo reduzidos a prata metálica (Nox = 0), de acordo com a semirreação de redução abaixo, e têm seu Nox reduzido. A prata é o agente oxidante do processo (uma vez que promoveu a oxidação do cobre).

A equação global da reação é obtida pela combinação de ambas as semirreações, cancelando (algebricamente) os elétrons. Nesse caso, para que os elétrons possam ser cancelados, é necessária a multiplicação de toda a segunda semirreação pelo fator 2.
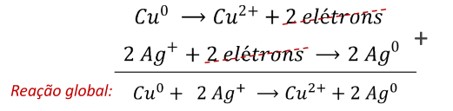
Como é feito o balanceamento por oxidorredução?
O balanceamento de reações de oxidorredução segue o princípio de conservação das massas, assim como para as reações comuns. O ponto de atenção nesse caso é em relação às cargas elétricas, que devem se manter iguais entre reagentes e produtos.
Para isso, uma sequência de etapas deve ser seguida.
-
1ª etapa: determinar o Nox de todos os elementos envolvidos.
-
2ª etapa: identificar quais elementos tiveram alteração de Nox.
-
3ª etapa: determinar a quantidade de elétrons transferidos.
-
4ª etapa: igualar as cargas elétricas em ambos os lados da reação, tornando a ΔNox de uma das espécies o coeficiente estequiométrico da outra. Aqui, apenas se consideram as espécies que sofreram reações redox.
-
5ª etapa: finalizar o balanceamento empregando o método de tentativa e erro.
Exemplo:
Vejamos um exemplo de aplicação dessas etapas para a reação entre ácido clorídrico e permanganato de potássio.
\(\mathbf{KMnO_4+HCl \to KCl+MnCl_2+ Cl_2+ H_2 O}\)
-
1ª etapa:
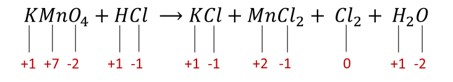
-
2ª etapa:
Identificar quais elementos tiveram alteração de Nox:
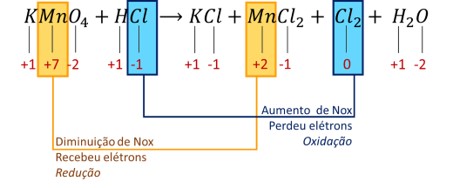
-
3ª etapa:
Na semirreação de redução, Mn7+ recebeu 5 elétrons e se converteu em Mn2+, registrando ΔNox = 5.
Na semirreação de oxidação, dois íons Cl1- doaram 1 elétron cada um, transformando-se em Cl2, em que cada átomo possui Nox = 0. Nesse processo, ΔNox = 2.
-
4ª etapa:
Aqui, apenas se consideram as espécies que sofreram reações redox. Para igualar as cargas elétricas, a ΔNox do manganês se torna o coeficiente estequiométrico do cloro. Da mesma forma, a ΔNox do cloro se torna o coeficiente do manganês.
\(\mathbf{KMnO_4+HCl \to KCl+{\color{royalblue}2} \ MnCl_2+ {\color{orange}5}\ Cl_2+ H_2 O}\)
Essa alteração deve ser feita no lado (reagentes ou produtos) que tiver o maior número de espécies envolvidas no processo redox. Se forem iguais, deve-se considerar o lado que tiver o maior número de substâncias.
-
5ª etapa:
Por tentativa e erro, acertam-se os coeficientes estequiométricos das espécies.
Adicionar “2” em KMnO4 para ajustar o coeficiente do manganês:
\(\mathbf{{\color{red}2}\ KMnO_4+HCl \to KCl+2\ MnCl_2+ 5\ Cl_2+ H_2 O}\)
Adicionar “2” em KCl para ajustar o coeficiente do potássio:
\(\mathbf{2\ KMnO_4+HCl \to {\color{red}2}\ KCl+2\ MnCl_2+ 5\ Cl_2+ H_2 O}\)
Adicionar “16” em HCl para ajustar o coeficiente do cloro:
\(\mathbf{2\ KMnO_4+{\color{red}{16}}\ HCl \to 2\ KCl+2\ MnCl_2+ 5\ Cl_2+ H_2 O}\)
Adicionar “8” em H2O para ajustar o coeficiente do hidrogênio:
\(\mathbf{2\ KMnO_4+16\ HCl \to 2\ KCl+2\ MnCl_2+ 5\ Cl_2+ {\color{red}8}\ H_2 O}\)
O coeficiente para o oxigênio foi automaticamente ajustado, mantendo-se 8 átomos para cada lado.
Para finalizar, cheque se as quantidades de átomos de todos os elementos estão realmente iguais em ambos os lados da reação.
Portanto, a equação de oxidorredução balanceada fica:
\(\mathbf{2\ KMnO_4+16\ HCl \to 2\ KCl+2\ MnCl_2+ 5\ Cl_2+ 8\ H_2 O}\)
Exemplos de oxidorredução no cotidiano
Reações de oxidorredução estão muito mais presentes em nosso dia a dia do que podemos imaginar:
→ Fotossíntese

A fotossíntese é um importante processo pelo qual as plantas e algas produzem seu próprio alimento por meio de água, luz solar e dióxido de carbono (CO2). Além de carboidrato para a nutrição vegetal, a fotossíntese também gera como produto grande parte do oxigênio necessário à sobrevivência animal. Ademais, há consumo de CO2, gás contribuinte para o efeito estufa.
O processo envolvido na fotossíntese é complexo e é apresentado de forma resumida pela equação química abaixo. Nessa reação, a molécula de água é quebrada pela oxidação do hidrogênio, cedendo elétrons para a redução da molécula de CO2, a qual dará origem às moléculas de carboidratos (no exemplo, a glicose). O gás oxigênio é o outro produto da reação, derivando da oxidação da água.
\(\mathbf{6\ CO_2+12\ H_2 O+luz \to C_6 H_12 O_6+6\ O_2+6\ H_2 O}\)
→ Respiração celular
A respiração celular é um processo redox exatamente oposto à fotossíntese, em que a glicose é oxidada pelo oxigênio do ar (obtido pela inspiração), resultando na liberação de CO2, vapor de água e energia, que é usada pelo organismo para processos vitais.
→ Corrosão

A corrosão é uma reação de oxidorredução em que há a degradação de um material pela interação com outro. Ocorre com metais ou ligas metálicas, gerando produtos de corrosão e energia. A ocorrência de corrosão está associada a grandes prejuízos financeiros e riscos de segurança, pois pode comprometer estruturas metálicas de edifícios e pontes, maquinário industrial, automóveis e objetos metálicos.
O exemplo clássico é a corrosão do ferro, que ocorre em ambientes úmidos e expostos ao oxigênio. Nesse processo, o ferro é oxidado a íons Fe2+, doando elétrons para o oxigênio, que sofre redução a íons hidroxila (OH-). Essa reação forma o hidróxido de ferro (II), que sofre uma nova oxidação, gerando o hidróxido de ferro (III), representado por Fe(OH)3 ou Fe2O3 . 3 H2O e que possui a coloração alaranjada típica da ferrugem.
\(\mathbf{2\ Fe(s)+ O_2 (g)+2\ H_2 O(l) \to 2\ Fe(OH)_2\ (s)}\)
\(\mathbf{ 2\ Fe(OH)_2 +\frac{1}2 O_2 (g)+ H_2 O(l) \to 2\ Fe(OH)_3\ (s)}\)
Acesse também: Corrosão e proteção de metais — como evitar o desgaste?
→ Combustão
A combustão, ou reação de queima, é uma reação de oxidorredução exotérmica em que um material combustível sofre oxidação, transferindo elétrons para o oxigênio, chamado comburente e que sofre redução.
A energia liberada em reações de queima é aproveitada para movimentar veículos, máquinas, fogões e caldeiras. No organismo, as células realizam combustão (oxidação pela ação de oxigênio) para gerar energia por meio dos alimentos.
A gasolina é formada basicamente por moléculas de octano. A reação de combustão da gasolina é expressa como:
\(\mathbf{C_8 H_18 (l)+\frac{25}2 O_2 (g) \to 8\ CO_2 (g)+9\ H_2 O(l)+energia}\)

A energia térmica gerada na combustão do octano é convertida em energia mecânica empregada para movimentar veículos. Nesse processo também é formado CO2, que é um gás de efeito estufa.
→ Pilhas e baterias
As pilhas e baterias são dispositivos que convertem energia química de uma reação de oxidorredução em energia elétrica, empregada para alimentar dispositivos eletrônicos e elétricos.
Existem diversas combinações de materiais que compõem as pilhas e baterias, a depender da quantidade de energia necessária para determinada aplicação. As baterias automotivas são conhecidas como chumbo-ácido e são compostas por chumbo (Pb) e óxido de chumbo (PbO2) embebidos em ácido sulfúrico. Nesse dispositivo, o chumbo metálico é oxidado a PbSO4, cedendo elétrons para a reação de redução do PbO2, gerando também PbSO4 como produto. A reação global para esse processo é:
\(\mathbf{PbO_2\ (s)+Pb(s)+2\ H_2 SO_4 (aq) \to 2\ PbSO_4+2\ H_2 O\ (l)}\)
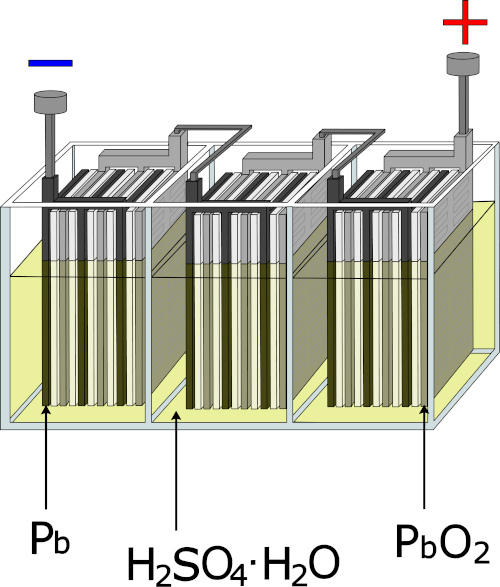
Os veículos elétricos se movimentam graças à energia gerada em baterias de íons-lítio, em que ocorre reação de oxidorredução entre o lítio e eletrodos de carbono.
Saiba também: Diferença de potencial de uma pilha — uma medição afetada pela redução e pela oxidação dos eletrodos
Exercícios resolvidos sobre oxidorredução
Questão 1
(UFRGS) A cebola, por conter derivados de enxofre, pode escurecer talheres de prata. Esse fenômeno pode ser representado pela equação:
\(\mathbf{4\ Ag\ (s)+2\ H_2 S\ (g)+ O_2 (g) \to 2\ Ag_2 S\ (s)+2\ H_2 O\ (l)}\)
A respeito deste fato, pode-se afirmar que:
A) a prata sofre redução.
B) a prata é o agente redutor.
C) o oxigênio sofre oxidação.
D) o H2S é o agente oxidante.
E) o enxofre sofre redução.
Resolução:
Alternativa B
Analisando a reação, percebemos que é necessário identificar os elementos que sofrem alteração de Nox e, com isso, conhecer se são oxidados ou reduzidos.
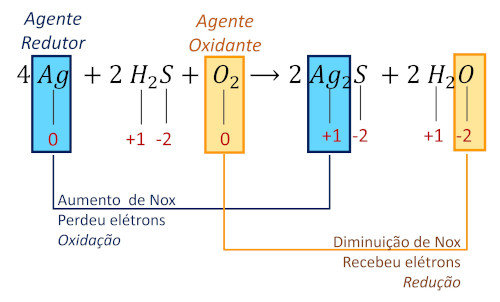
Item A incorreto, pois a prata é oxidada, sendo o agente redutor (item B correto), pois causa a redução do oxigênio.
Item C incorreto. O oxigênio é reduzido.
Item D incorreto, pois o H2S não participa dos processos de transferência de elétrons, logo não é oxidado ou reduzido.
Item E incorreto. O enxofre não tem seu Nox alterado, logo não doa e nem recebe elétrons.
Questão 2
(Enem) Atualmente, soldados em campo, seja em treinamento ou em combate, podem aquecer suas refeições, prontas e embaladas em bolsas plásticas, utilizando aquecedores químicos, sem precisar fazer fogo. Dentro dessas bolsas existe magnésio metálico em pó e, quando o soldado quer aquecer a comida, ele coloca água dentro da bolsa, promovendo a reação descrita pela equação química:
\(\mathbf{Mg\ (s)+2\ H_2 O\ (l) \to Mg(OH)_2\ (s)+ H_2\ (g)+350\ kJ}\)
O aquecimento dentro da bolsa ocorre por causa da
A) redução sofrida pelo oxigênio, que é uma reação exotérmica.
B) oxidação sofrida pelo magnésio, que é uma reação exotérmica.
C) redução sofrida pelo magnésio, que é uma reação exotérmica.
D) oxidação sofrida pelo hidrogênio, que é uma reação exotérmica.
E) redução sofrida pelo hidrogênio, que é uma reação endotérmica.
Resolução:
Alternativa B
Analisando a reação, deve-se identificar as espécies que tiveram seu Nox alterado.
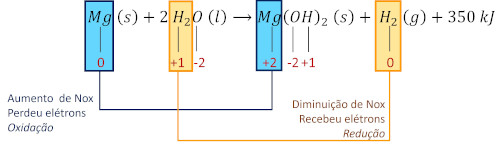
A reação libera energia, logo é exotérmica.
Item A incorreto. O oxigênio não tem seu Nox alterado.
Item B correto e item C incorreto. O magnésio é oxidado, e a reação é exotérmica.
Itens D e E incorretos. O hidrogênio sofre redução, e a reação é exotérmica.