Elementos químicos
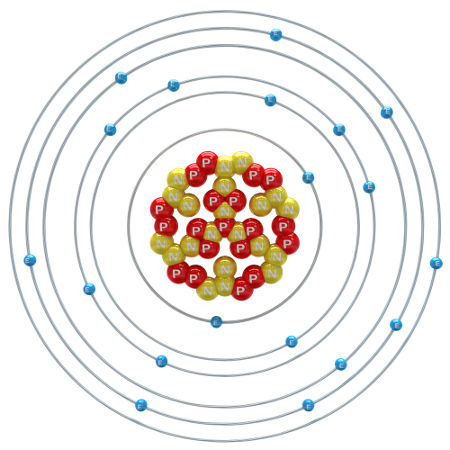
Os elementos químicos são formados por átomos com o mesmo número de prótons. Eles são identificados por um símbolo de até três letras e organizados na tabela periódica.
Por Jhonilson Pereira Gonçalves
PUBLICIDADE
O elemento químico é a base de todas as substâncias conhecidas. Ele é formado por átomos com o mesmo número de prótons, logo, sempre que houver átomos com números atômicos iguais, trata-se de um mesmo elemento.
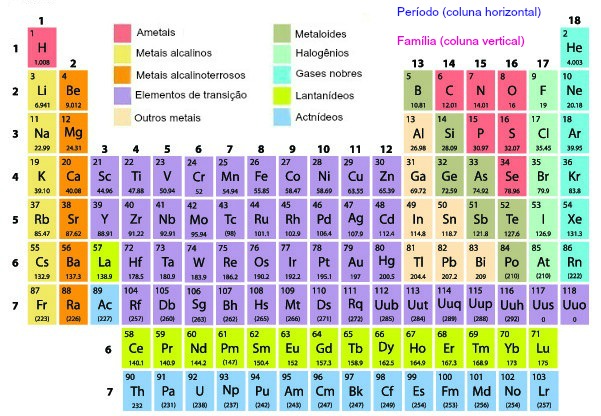
Atualmente são conhecidos 118 elementos químicos, os quais estão organizados na tabela periódica em grupos (colunas) e períodos (filas horizontais), sendo 92 naturais e 26 artificiais.
Leia também: Como a tabela periódica é organizada?
Resumo sobre os elementos químicos
- Elementos químicos são substâncias puras e fundamentais na Química.
- Cada elemento é composto por átomos idênticos, com o mesmo número de prótons.
- São a base da matéria e não podem ser decompostos em substâncias mais simples por processos químicos.
- São representados na tabela periódica com símbolos químicos únicos.
- São organizados em grupos (famílias) e períodos com base em suas propriedades e características.
- Suas propriedades físicas incluem ponto de fusão, ponto de ebulição e densidade.
- Suas propriedades químicas incluem reatividade e capacidade de formar ligações.
- A combinação de elementos forma compostos químicos, a base de todas as substâncias.
- Cada elemento desempenha um papel crucial na compreensão das propriedades da matéria e das interações químicas.
Videoaula sobre os elementos químicos
O que são elementos químicos?
Elementos químicos são substâncias puras e fundamentais que não podem ser decompostas em substâncias mais simples por meio de processos químicos comuns. Sendo assim, cada elemento é composto por átomos idênticos, que têm o mesmo número de prótons no núcleo. Além disso, cada um deles possui um símbolo químico único, geralmente composto por uma ou duas letras, que é usado para identificá-lo.

Vale ressaltar que cada elemento tem características únicas, incluindo suas propriedades físicas (como ponto de fusão, ponto de ebulição e densidade) e suas propriedades químicas (como reatividade e capacidade de formar ligações químicas). A combinação de diferentes elementos em várias proporções resulta na formação de compostos químicos, que são a base de todas as substâncias que encontramos no mundo ao nosso redor.
Lista de todos os elementos químicos
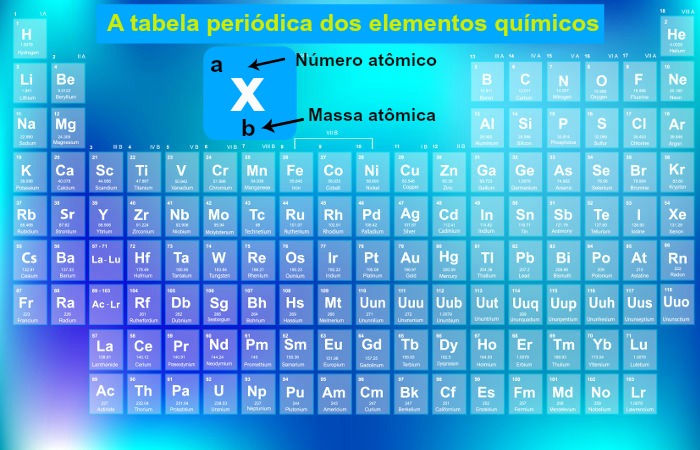
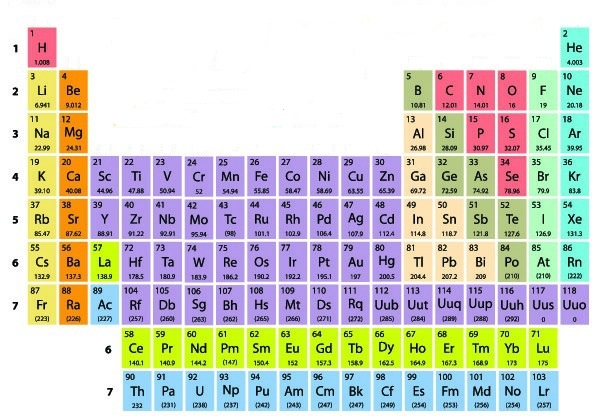
Os elementos químicos são organizados na tabela periódica seguindo a ordem dos seus números atômicos, formando filas horizontais (períodos) e colunas (grupos). O quadro abaixo apresenta os nomes de todos os elementos conhecidos e seus respectivos símbolos e números atômicos (Z).
|
Z |
Nome |
Símbolo |
Z |
Nome |
Símbolo |
Z |
Nome |
Símbolo |
|
1 |
hidrogênio |
H |
41 |
nióbio |
Nb |
81 |
tálio |
Tl |
|
2 |
hélio |
He |
42 |
molibdênio |
Mo |
82 |
chumbo |
Pb |
|
3 |
lítio |
Li |
43 |
tecnécio |
Tc |
83 |
bismuto |
Bi |
|
4 |
berílio |
Be |
44 |
rutênio |
Ru |
84 |
polônio |
Po |
|
5 |
boro |
B |
45 |
ródio |
Rh |
85 |
astato |
At |
|
6 |
carbono |
C |
46 |
paládio |
Pd |
86 |
radônio |
Rn |
|
7 |
nitrogênio |
N |
47 |
prata |
Ag |
87 |
frâncio |
Fr |
|
8 |
oxigênio |
O |
48 |
cádmio |
Cd |
88 |
rádio |
Ra |
|
9 |
flúor |
F |
49 |
índio |
In |
89 |
actínio |
Ac |
|
10 |
neônio |
Ne |
50 |
estanho |
Sn |
90 |
tório |
Th |
|
11 |
sódio |
Na |
51 |
antimônio |
Sb |
91 |
protactínio |
Pa |
|
12 |
magnésio |
Mg |
52 |
telúrio |
Te |
92 |
urânio |
U |
|
13 |
alumínio |
Al |
53 |
iodo |
I |
93 |
netúnio |
Np |
|
14 |
silício |
Si |
54 |
xenônio |
Xe |
94 |
plutônio |
Pu |
|
15 |
fósforo |
P |
55 |
césio |
Cs |
95 |
amerício |
Am |
|
16 |
enxofre |
S |
56 |
bário |
Ba |
96 |
cúrio |
Cm |
|
17 |
cloro |
Cl |
57 |
lantânio |
La |
97 |
berquélio |
Bk |
|
18 |
argônio |
Ar |
58 |
cério |
Ce |
98 |
califórnio |
Cf |
|
19 |
potássio |
K |
59 |
praseodíomio |
Pr |
99 |
einstênio |
Es |
|
20 |
cálcio |
Ca |
60 |
neodímio |
Nd |
100 |
férmio |
Fm |
|
21 |
escândio |
Sc |
61 |
promécio |
Pm |
101 |
mendelévio |
Md |
|
22 |
titânio |
Ti |
62 |
samário |
Sm |
102 |
nobélio |
No |
|
23 |
vanádio |
V |
63 |
európio |
Eu |
103 |
laurêncio |
Lr |
|
24 |
crômio |
Cr |
64 |
gadolínio |
Gd |
104 |
rutherfódio |
Rf |
|
25 |
manganês |
Mn |
65 |
térbio |
Tb |
105 |
dúbnio |
Db |
|
26 |
ferro |
Fe |
66 |
disprósio |
Dy |
106 |
seabórgio |
Sg |
|
27 |
cobalto |
Co |
67 |
hólmio |
Ho |
107 |
bóhrio |
Bh |
|
28 |
níquel |
Ni |
68 |
érbio |
Er |
108 |
hássio |
Hs |
|
29 |
cobre |
Cu |
69 |
túlio |
Tm |
109 |
meitnério |
Mt |
|
30 |
zinco |
Zn |
70 |
itérbio |
Yb |
110 |
darmstádio |
Ds |
|
31 |
gálio |
Ga |
71 |
lutécio |
Lu |
111 |
roentgênio |
Rg |
|
32 |
germânio |
Ge |
72 |
háfnio |
Hf |
112 |
copernício |
Cn |
|
33 |
arsênio |
As |
73 |
tântalo |
Ta |
113 |
nihônio |
Nh |
|
34 |
selênio |
Se |
74 |
tungstênio |
W |
114 |
fleróvio |
Fl |
|
35 |
bromo |
Br |
75 |
rênio |
Re |
115 |
moscóvio |
Mc |
|
36 |
criptônio |
Kr |
76 |
ósmio |
Os |
116 |
livermório |
Lv |
|
37 |
rubídio |
Rb |
77 |
irídio |
Ir |
117 |
tenesso |
Ts |
|
38 |
estrôncio |
Sr |
78 |
platina |
Pt |
118 |
oganessônio |
Og |
|
39 |
ítrio |
Y |
79 |
ouro |
Au |
119 |
||
|
40 |
zircônio |
Zr |
80 |
mércurio |
Hg |
120 |
Classificação periódica dos elementos químicos
Trata-se de um arranjo sistemático de todos os elementos químicos conhecidos com base em suas propriedades e características comuns. Esse arranjo é chamado de tabela periódica, cuja organização é feita de forma que os elementos com propriedades semelhantes sejam agrupados juntos, permitindo identificar tendências e padrões característicos de cada grupo.
Vale ressaltar que a classificação periódica foi originalmente proposta por Dmitri Mendeleev em 1869 e que atualmente os elementos são organizados de acordo com seu número atômico, que representa a quantidade de prótons no núcleo de um átomo. Diante disso, podemos salientar as principais divisões da tabela periódica:
- Períodos: As fileiras horizontais na tabela periódica são chamadas de períodos, e cada período corresponde a um nível de energia eletrônica ocupado pelos elétrons nos átomos dos elementos. Conforme você se move da esquerda para a direita em um período, o número atômico aumenta.
- Grupos (ou famílias): Já as colunas verticais na tabela periódica são conhecidas como grupos ou famílias. Nesse caso os elementos em um mesmo grupo possuem propriedades químicas semelhantes, porque eles têm o mesmo número de elétrons na camada de valência (a camada mais externa de elétrons). Isso influencia diretamente como os átomos interagem com outros átomos para formar compostos químicos.
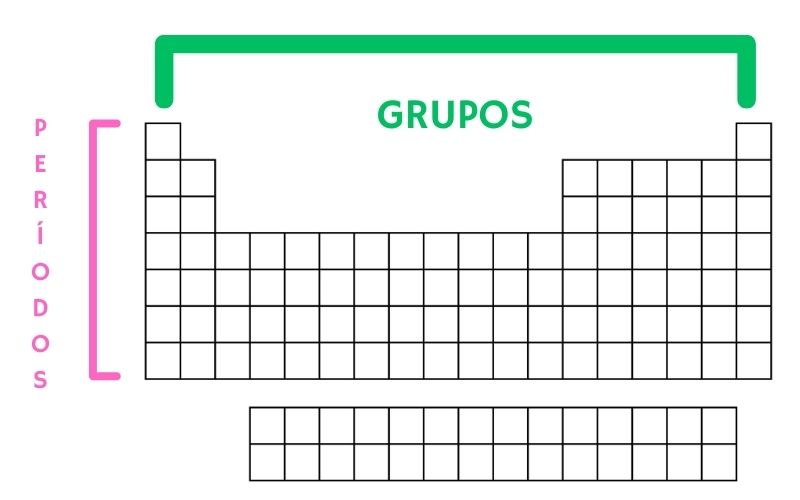
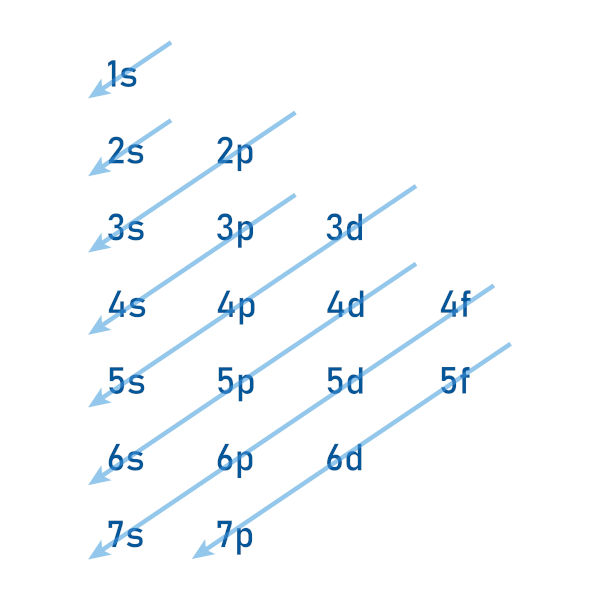
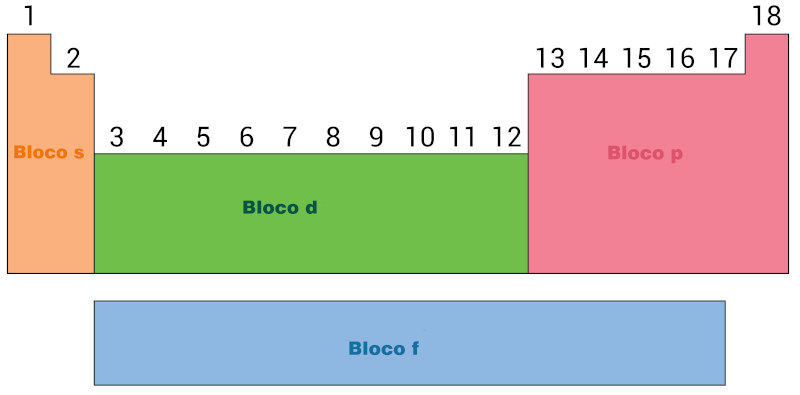
- Blocos: A tabela periódica é dividida em blocos, e cada um deles é associado a um subnível de energia específico. Os principais blocos são: s, p, d e f, e eles determinam a ordem em que os elétrons são preenchidos nas camadas eletrônicas.
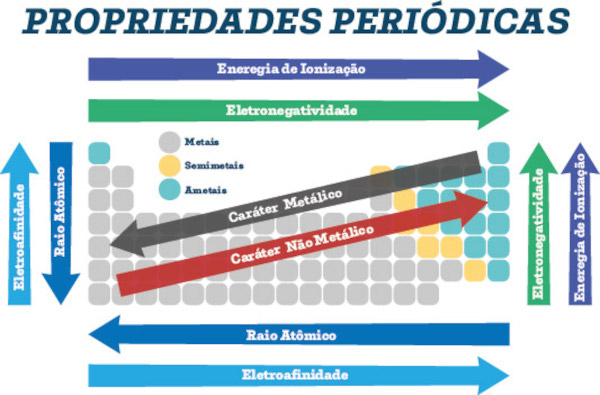
Sendo assim, a organização periódica dos elementos revela tendências previsíveis em suas propriedades físicas e químicas à medida que você se move de cima para baixo e da esquerda para a direita na tabela. Alguns exemplos incluem raio atômico, energia de ionização, afinidade eletrônica e eletronegatividade.
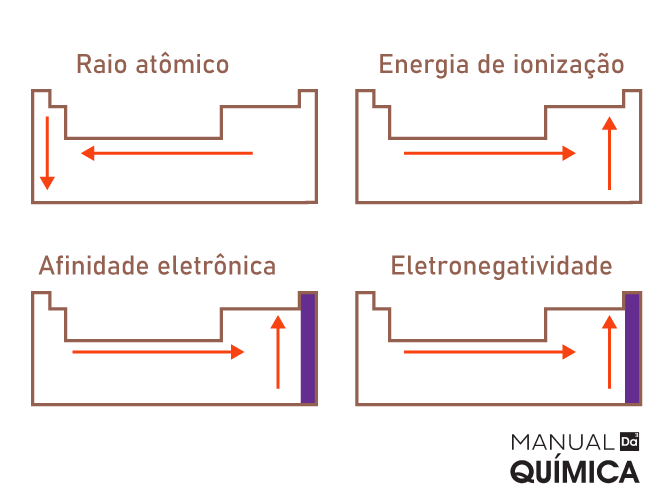
Além disso, à medida que você se move de cima para baixo em um grupo, os átomos tendem a ficar maiores devido ao aumento do número de níveis de energia. À medida que você se move da esquerda para a direita em um período, o tamanho do átomo geralmente diminui, devido ao aumento da carga nuclear efetiva, apesar do aumento no número de elétrons.
Por fim, a tabela periódica também é dividida em três categorias principais: metais, não metais e metal de transição. Os metais são geralmente bons condutores de eletricidade, os não metais têm propriedades opostas e os metais de transição são encontrados no bloco d.
Leia também: Quais são as propriedades periódicas?
Propriedades dos elementos químicos
Os elementos químicos exibem uma ampla variedade de propriedades físicas e químicas que são fundamentais para entender como eles interagem entre si e a natureza da matéria. Diante disso, podemos destacar as principais, como:
- Peso atômico: é a média ponderada das massas dos isótopos desse elemento. Ele é expresso em unidades de massa atômica (u) e é usado para calcular quantidades em reações químicas.
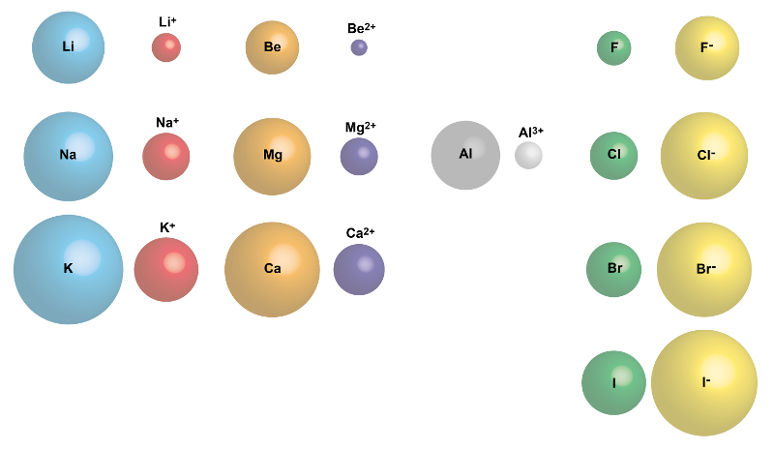
- Raio atômico: refere-se à distância média entre o núcleo de um átomo e seus elétrons externos. O raio atômico aumenta de cima para baixo em um grupo e diminui da esquerda para a direita em um período.
- Energia de ionização: é a quantidade de energia necessária para remover um elétron de um átomo neutro para formar um íon positivo. Geralmente, a energia de ionização diminui de cima para baixo em um grupo e aumenta da esquerda para a direita em um período.
- Afinidade eletrônica: é a energia liberada quando um átomo neutro ganha um elétron para formar um íon negativo. Ela tende a aumentar da esquerda para a direita em um período e pode variar em grupos.
- Eletronegatividade: é a medida da capacidade de um átomo de atrair elétrons em uma ligação química. Ela segue padrões semelhantes à afinidade eletrônica, aumentando da esquerda para a direita em um período e diminuindo de cima para baixo em um grupo.
- Estado de oxidação: os elementos podem exibir diferentes estados de oxidação em compostos químicos, refletindo o número de elétrons que eles ganham, perdem ou compartilham durante reações químicas.
- Ponto de fusão e ebulição: temperaturas nas quais um elemento muda de fase, passando do estado sólido para o líquido (ponto de fusão) e do líquido para o gasoso (ponto de ebulição). Essas temperaturas variam dependendo das forças de atração entre os átomos no estado sólido e líquido.
- Condutividade elétrica e térmica: os metais são geralmente bons condutores de eletricidade e calor devido à mobilidade dos elétrons em sua estrutura cristalina. Os não metais, por outro lado, geralmente têm baixa condutividade elétrica e térmica.
Exercícios resolvidos sobre elementos químicos
Questão 1
Os elementos químicos são organizados na tabela periódica em grupos (colunas) e períodos (fila horizontal). Os elementos que estão dispostos no mesmo grupo possuem em comum:
a) o número atômico.
b) o número de elétrons na camada de valência.
c) o símbolo químico.
d) o número de nêutrons.
e) o raio atômico.
Gabarito: Letra B. Os elementos químicos que estão no mesmo grupo (coluna) possuem o mesmo número de elétrons na camada de valência (última camada eletrônica).
Questão 2
De acordo com a classificação periódica dos elementos químicos, os elementos fósforo (P), cálcio (Ca) e cobre (Cu) estão localizados respectivamente nos blocos:
a) s, p, f.
b) d, p, s.
c) p, d, f.
d) p, d, s.
e) p, s, d.
Gabarito: Letra E. O fósforo está localizado no bloco “p”, enquanto o cálcio está no “s” e o cobre no “d” devido às suas distribuições eletrônicas.
Fontes:
BALAREW, C. The periodic table of chemical elements – history, nature, meaning. Pure and Applied Chemistry, v. 91, n. 12, p. 2037–2042, 18 dez. 2019.
CRAVEIRO, A. C. Química Química Geral e Orgânica. 3. ed. Fortaleza - CE: EdUECE, 2013.
ROUVRAY, D. H. Periodic Table: Historical Aspects. In: Encyclopedia of Inorganic Chemistry. Chichester, UK: John Wiley & Sons, Ltd, 2006. p. 1–10.
TOLENTINO, M.; ROCHA-FILHO, R. C.; CHAGAS, A. P. Alguns aspectos históricos da classificação periódica dos elementos químicos. Química Nova, v. 20, n. 1, p. 103–117, 1997.