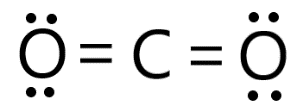Ligação covalente
A ligação covalente é um dos tipos de ligação química e ocorre mediante o compartilhamento de elétrons entre dois átomos.
Por Ana Luiza Lorenzen Lima

PUBLICIDADE
A ligação covalente é um dos tipos de ligação química, fenômeno pelo qual os átomos se unem para formar moléculas e substâncias.
Na ligação covalente, a união entre átomos ocorre por meio do compartilhamento de elétrons de valência. Na formação dessa ligação, os átomos envolvidos alcançam uma condição de estabilidade de energia quando preenchem a última camada com oito elétrons, de acordo com a teoria do octeto.
De forma geral, ligações covalentes ocorrem entre elementos não metálicos e entre hidrogênio e não metais. São também conhecidas como ligações moleculares, pois dão origem às moléculas de diferentes tamanhos pela associação sucessiva entre átomos.
Leia também: Ligações de hidrogênio — o tipo de força intermolecular mais intenso que existe
Resumo sobre ligação covalente
-
A ligação covalente é um tipo de ligação química.
-
As ligações covalentes são formadas pelo compartilhamento de elétrons de valência entre dois átomos.
-
Cada átomo atinge a estabilidade quando preenche a sua camada de valência com oito elétrons.
-
Átomos não metálicos e o hidrogênio participam das ligações covalentes.
-
As ligações covalentes podem ser polares ou apolares, conforme a eletronegatividade dos átomos envolvidos.
-
Um, dois ou três pares de elétrons podem ser compartilhados entre dois átomos, originando ligações simples, duplas ou triplas respectivamente.
-
As ligações covalentes são formadas por ligações do tipo sigma e/ou pi:
-
Ligações simples (–): formadas por uma ligação σ.
-
Ligações duplas (=): formadas por uma ligação σ e uma ligação π.
-
Ligações triplas (≡): formadas por uma ligação σ e duas ligações π.
-
-
Além da ligação covalente (compartilhamento de elétrons), existem a ligação iônica (doação de elétrons) e a ligação metálica (ocorre somente entre metais e ocorre a deslocalização dos elétrons ao longo da estrutura metálica).
Videoaula sobre ligação covalente
O que é ligação covalente?
Ligação covalente é um tipo de ligação química estabelecida quando átomos se unem por compartilhamento de elétrons. Alguns átomos compartilham elétrons porque, dessa forma, adquirem a quantidade de elétrons necessária para atingir a configuração de gás nobre, mantendo as respectivas eletrosferas preenchidas com oito elétrons.
Essa configuração é desejada porque o átomo se torna energeticamente mais estável. Por exemplo, o átomo de oxigênio (Z=6) possui seis elétrons em sua camada de valência, necessitando de dois elétrons adicionais para atingir a estabilidade. Para isso, é favorável compartilhar dois elétrons com outro átomo de oxigênio, atingindo ambos essa condição.
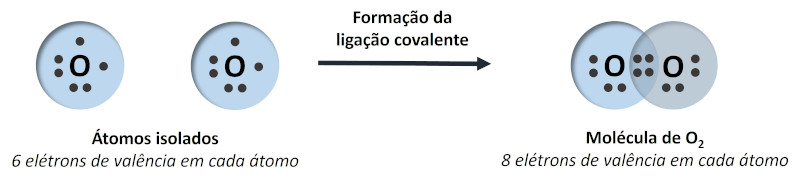
Os átomos que se mantêm unidos por ligações covalentes são chamados de moléculas, e as substâncias formadas por essas moléculas são ditas substâncias moleculares. Por isso, a ligação covalente também pode ser chamada de ligação molecular.
Veja alguns exemplos de ocorrência de ligação covalente:
|
Substância |
Representação |
Observação |
|
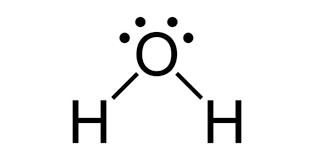
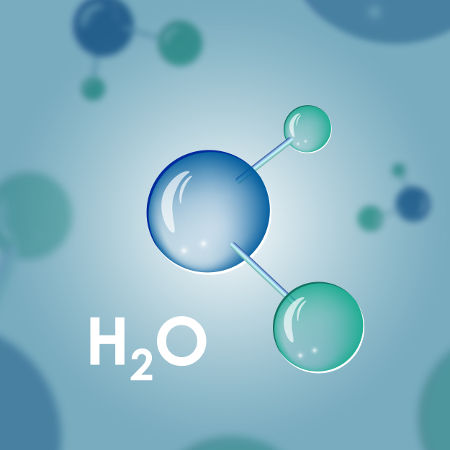
Água (H2O) |
|
Existência de ligações covalentes entre o oxigênio e o hidrogênio. |
|
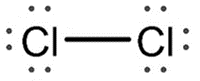
Gás cloro (Cl2) |
|
Na molécula de gás cloro, dois átomos compartilham um par de elétrons. |
|
Dióxido de carbono (CO2) |
|
Nessa molécula, há o compartilhamento de dois pares de elétrons entre o átomo de carbono e um dos átomos de oxigênio, formando uma ligação dupla. Nesse caso, o carbono atinge a estabilidade compartilhando 4 elétrons com os átomos de oxigênio. |
Nota: Os traços representam a ligação covalente.
Quais são as características da ligação covalente?
A ligação covalente se estabelece entre elementos cuja diferença de eletronegatividade é menor do que 1,7. A eletronegatividade é a propriedade que determina a capacidade de um átomo atrair elétrons para si mesmo. Portanto, para que o compartilhamento de elétrons efetivamente aconteça, é essencial que os átomos possuam eletronegatividades iguais ou muito próximas, para que os elétrons se mantenham distribuídos entre eles.
Dessa forma, as ligações covalentes se estabelecem entre:
-
Elementos não metálicos;
-
Hidrogênio e elementos não metálicos;
-
Átomos de hidrogênio.
No caso da formação de uma molécula com átomos iguais, não há diferença de eletronegatividade e se diz que a ligação é uma ligação covalente apolar.
Tomando como exemplo o gás cloro (Cl2), a eletronegatividade do cloro é de 3,16, assim:
\(\mathbf{\triangle \ eletronegatividade=3,16-3,16=0 }\)
Portanto, no Cl2 existe ligação covalente apolar. Outros exemplos de moléculas com ligações covalentes apolares são as diatômicas O2, F2, He2, H2 e os hidrocarbonetos.
Quando a diferença de eletronegatividade entre os átomos é diferente de zero, mas se mantém dentro do intervalo de 1,7, a ligação é uma ligação covalente polar.
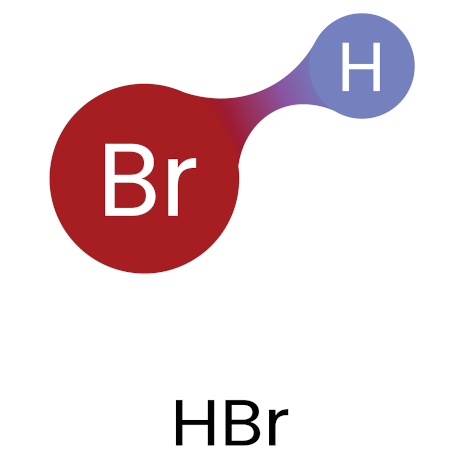
Tomando como exemplo o ácido bromídrico (HBr), a eletronegatividade do bromo é de 2,96, e, para o hidrogênio, é de 2,20, assim:
\(\mathbf{\triangle\ eletronegatividade=2,96-2,20=0,76 }\)
Portanto, o HBr estabelece ligação covalente polar. Nesses casos, o par de elétrons é deslocado na direção do átomo que possui maior eletronegatividade, formando uma ligação polarizada. No caso do HBr, os elétrons estariam mais próximos do átomo de bromo do que do átomo de hidrogênio, como indicado pela coloração vermelha em um mapa de distribuição eletrônica (abaixo). O vermelho indica maior densidade eletrônica em uma extremidade da molécula.
Substâncias formadas por ligações covalentes registram temperaturas de ebulição e de fusão baixas, quando comparadas aos compostos iônicos. Compostos covalentes não conduzem corrente elétrica.
Como a ligação covalente ocorre?
A formação da ligação covalente é uma forma que alguns átomos adotam para alcançar a condição de estabilidade de energia. Essa condição é explicada para a maior parte dos átomos, de acordo com a teoria do octeto.
Na teoria do octeto, um átomo se torna estável quando passa a possuir oito elétrons na camada de valência (última camada da eletrosfera ocupada por elétrons), semelhantemente ao elemento do grupo 18 (gás nobre) do mesmo período da Tabela Periódica. A característica de espécies com a camada de valência completa é a baixa reatividade.
Elementos químicos com cinco, seis e sete elétrons na camada de valência possuem marcante tendência de compartilhar elétrons com outros átomos, estabelecendo ligações covalentes, com a intenção de alcançar a estabilidade energética.
A ilustração abaixo demonstra a formação de ligações covalentes entre o carbono e o hidrogênio, para a formação da molécula de metano (CH4).
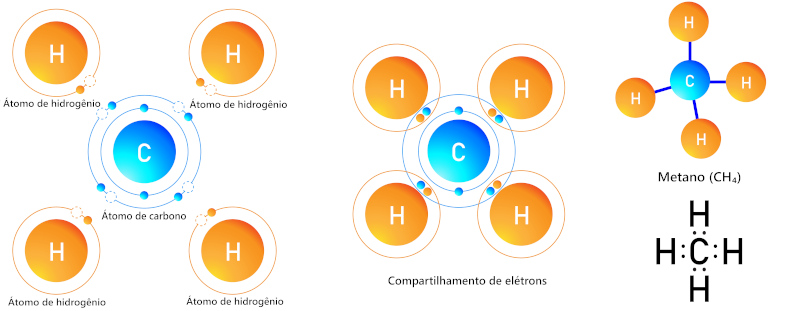
Nessa molécula, o compartilhamento de elétrons é favorável tanto ao carbono quanto ao hidrogênio, pois assim ambos alcançam a sua condição de estabilidade.
Para o hidrogênio, que possui apenas o orbital 1s, a condição de máxima estabilidade é alcançada com dois elétrons de valência. Já o carbono torna-se estável com oito elétrons na última camada. Para isso, o átomo de carbono (inicialmente com quatro elétrons) compartilha elétrons com outros quatro átomos de hidrogênio, alcançando a condição de oito elétrons na última camada.
Quais são os tipos de ligação covalente?
A ligação covalente pode acontecer de três formas, dependendo da quantidade de elétrons compartilhados entre dois átomos:
-
Ligação covalente simples: é formada pelo compartilhamento de um único par de elétrons. A ocorrência dessa reação é representada por uma barra unindo dois átomos e é simplesmente denominada ligação simples.
-
Ligação covalente dupla: é formada pelo compartilhamento de dois pares de elétrons entre átomos. A ocorrência dessa reação é representada por duas barras paralelas unindo dois átomos e pode ser chamada apenas de ligação dupla.
-
Ligação covalente tripla: ocorre quando há o compartilhamento de três pares de elétrons entre átomos. A ocorrência dessa reação é representada por três barras paralelas unindo dois átomos e pode ser chamada apenas de ligação tripla.
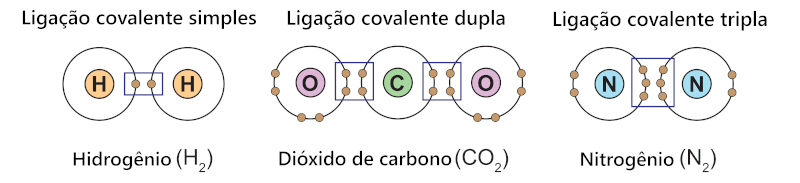
Os três tipos de ligações covalentes têm em comum a existência de uma única ligação sigma (σ), constituída pela interpenetração de nuvens eletrônicas localizadas no mesmo eixo do átomo. Essa geometria “alinhada” favorece o compartilhamento de elétrons entre dois átomos, evento que pode ocorrer entre dois orbitais s, dois orbitais p ou, ainda, entre um orbital s e um orbital p.
As ligações covalentes duplas e triplas possuem, além da ligação sigma, a ligação pi (π). A formação de uma ligação π acontece pela interpenetração de orbitais p paralelos entre si, isto é, precisam estar posicionados lado a lado.
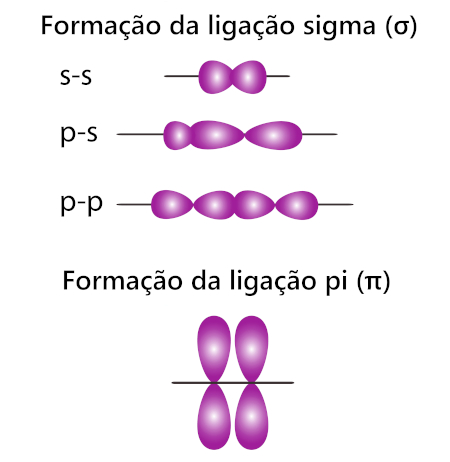
As ligações sigma e pi são os nomes dados aos arranjos espaciais entre os orbitais atômicos que permitem que aconteça o compartilhamento de elétrons entre eles.
Fórmulas da ligação covalente
As moléculas podem ser representadas de diferentes formas, com maior ou menor detalhamento, em relação às ligações covalentes estabelecidas entre os átomos.
-
Fórmula molecular: é o modo mais simples de representar uma molécula, indicando apenas a natureza e a quantidade dos átomos presentes.
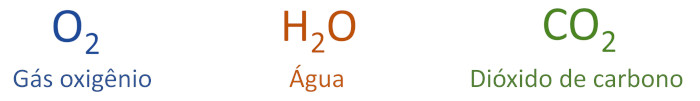
-
Fórmula estrutural plana: fornece mais detalhes, deixando explícito como os átomos se ligam entre si, sendo possível identificar se as ligações covalentes são simples, duplas ou triplas por meio da sua representação em barra ou traços.
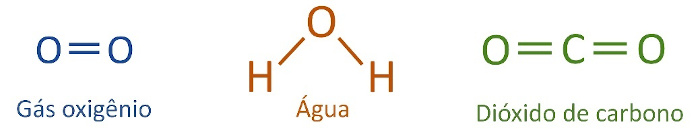
-
Fórmula eletrônica (fórmula de Lewis): além de especificar a natureza e a quantidade de átomos, indica também a quantidade de elétrons de valência de cada átomo, representando-os por “pontinhos”. Os pares eletrônicos formados pelo compartilhamento de elétrons também são mostrados nessa representação.
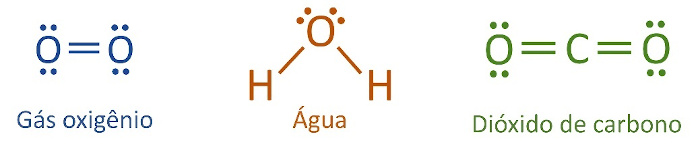
Quais são as diferenças entre ligação covalente, ligação iônica e ligação metálica?
As ligações covalentes, iônicas e metálicas são três diferentes formas de átomos se combinarem estabelecendo ligações químicas.
Acabamos de entender que as ligações covalentes se originam pelo compartilhamento de elétrons entre dois átomos, ambos buscando uma condição de estabilidade de acordo com a teoria do octeto.
Na ligação iônica ocorre o fenômeno de doação e recebimento de elétrons entre duas espécies, mantendo a intenção de que ambos os átomos se tornem estáveis. Na formação da ligação iônica, um dos átomos doa elétrons de sua camada de valência incompleta para outro, ficando as duas espécies com suas últimas camadas completas.
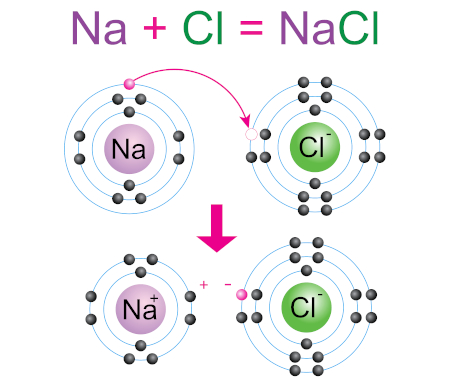
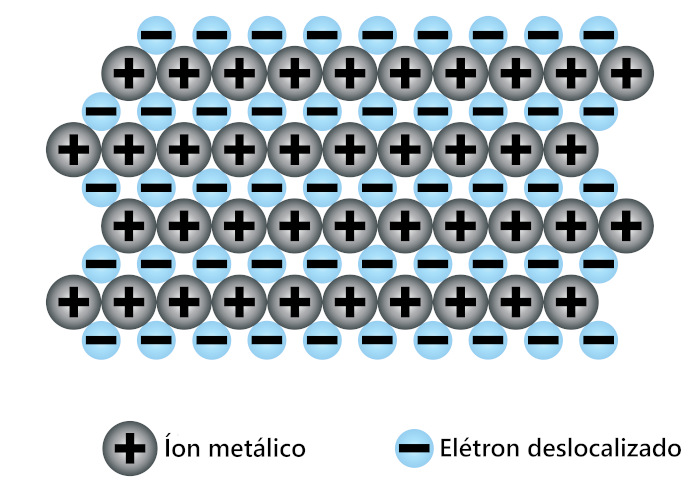
Por fim, a ligação metálica ocorre apenas entre átomos metálicos e se dá de acordo com a teoria do “mar de elétrons”, situação em que os elétrons ficam deslocalizados entre os átomos. Para entender isso, precisamos falar um pouco da estrutura atômica dos metais.
Os metais possuem os elétrons de valência mais afastados do núcleo e, por isso, essas espécies sentem em menor intensidade a atração nuclear, ficando presas mais fracamente ao átomo (baixa energia de ionização). No momento em que dois ou mais átomos metálicos se unem por meio da ligação metálica, há a liberação parcial de elétrons mais externos desses átomos, seguido da formação de cátions metálicos.
Os cátions possuem carga elétrica positiva e acabam sendo estabilizados pela carga elétrica negativa dos elétrons. Dessa forma, os elétrons adquirem liberdade de movimentação, sendo capazes de transitar ao longo da estrutura metálica. Daí deriva o termo mar de elétrons.
Saiba mais: Isomeria — o fenômeno em que compostos possuem a mesma fórmula molecular, mas são moléculas diferentes
Exercícios resolvidos sobre ligação covalente
Questão 1
(UFPA) As substâncias etano (C2H6), bromo (Br2), água (H2O) e cloreto de magnésio (MgCℓ2) apresentam seus átomos unidos, respectivamente, através de ligações:
A) covalentes, covalentes, covalentes e iônicas.
B) covalentes, iônicas, covalentes e iônicas.
C) metálicas, iônicas, iônicas e metálicas.
D) covalentes, covalentes, iônicas e iônicas.
E) covalentes, covalentes, iônicas e metálicas.
Resolução:
Alternativa A
Para a formação da ligação covalente, os átomos envolvidos no compartilhamento de elétrons devem possuir diferença de eletronegatividade igual a zero ou muito pequena (menor do que 1,7). Além disso, as ligações covalentes se estabelecem entre: i) elementos não metálicos; ii) hidrogênio e elementos não metálicos; e iii) átomos de hidrogênio.
Assim:
-
C2H6: ligação covalente (hidrogênio e não metal).
-
Br2: ligação covalente (ametal e não metal)
-
H2O: ligação covalente (hidrogênio e não metal).
-
MgCℓ2: ligação iônica (metal e não metal).
Questão 2
(UFJF) O óxido nitroso (N2O(g)), também conhecido como gás hilariante, foi o primeiro anestésico utilizado em cirurgias. Hoje, também pode ser utilizado na indústria automobilística para aumentar a potência de motores de combustão interna. Abaixo, está representada uma possibilidade da estrutura de Lewis dessa molécula.
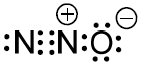
De acordo com a fórmula apresentada, marque a opção que descreve corretamente as ligações existentes no N2O.
A) Duas ligações covalentes, sendo uma dupla e uma simples.
B) Duas ligações iônicas.
C) Duas ligações covalentes simples.
D) Duas ligações covalentes, sendo uma tripla e uma simples.
E) Uma ligação iônica e duas ligações covalentes simples.
Resolução:
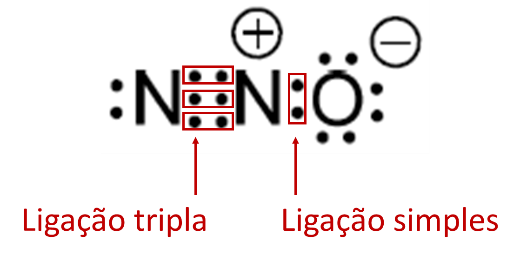
Alternativa D
A representação de moléculas com a fórmula de Lewis auxilia na observação dos pares eletrônicos, formados pelo compartilhamento de elétrons. Na molécula em questão, existem duas ligações covalentes, uma delas tripla e outra simples.
Fontes
CANTO, Eduardo Leite do. Química na abordagem do cotidiano, 1. 1° ed. São Paulo, Saraiva, 2016.
KOTZ, John C. et al. Química Geral: e reações químicas. 9ª ed., Tradução da edição norte americana. São Paulo: Cengage Learning, 2015. 1 v.