Eletroquímica
A eletroquímica é a área da Química que estuda a conversão de energia química em energia elétrica e vice-versa. Estuda as reações chamadas de reações de oxirredução.
Por Everton da Paz Silva

PUBLICIDADE
Eletroquímica é o ramo da Química que estuda as reações utilizadas para converter energia química em energia elétrica por meio de reações espontâneas, no caso das pilhas, assim como a conversão da energia elétrica em energia química em reações não espontâneas, no caso da eletrólise.
As reações abordadas dentro da eletroquímica são chamadas de reações de oxirredução (oxidação-redução) ou redox. O processo de oxirredução é caracterizado pela variação do número de oxidação (Nox) dos átomos envolvidos nessas reações. O átomo que perde elétrons sofre oxidação, sendo chamado de agente redutor, enquanto o átomo que ganha elétrons sofre redução, sendo chamado de agente oxidante.
Entre as principais aplicações da eletroquímica estão as pilhas e baterias, fundamentais para o funcionamento dos mais variados dispositivos eletrônicos presentes em nosso cotidiano, como celulares e computadores. Na indústria, processos de eletrólises são indispensáveis em processos de purificação de metais e produção de diferentes substâncias.
Leia também: Reações químicas — o que são e como ocorrem?
Resumo sobre eletroquímica
- Eletroquímica é a área da Química que estuda a conversão de energia química em elétrica, assim como a conversão de energia elétrica em energia química.
- Essa conversão ocorre por meio de reações de oxirredução.
- Reações de oxirredução são reações que ocorrem com transferência de elétrons entre espécies químicas.
- A espécie química cede elétrons sofre oxidação e é chamada de agente redutor.
- A espécie química ganha os elétrons sofre redução e é chamada de agente oxidante.
- A pilha de Volta foi o primeiro dispositivo eletroquímico desenvolvido.
- A pilha clássica é um dispositivo conhecido como célula voltaica ou célula galvânica.
- A eletrólise é um processo que usa corrente elétrica para gerar reações não espontâneas.
- Na eletrólise, os polos são invertidos: o ânodo é polo positivo, em que ocorre a oxidação; o cátodo é polo negativo, em que ocorre a redução.
- A eletroquímica é fundamental no desenvolvimento de dispositivos eletrônicos, como pilhas e baterias, e em processos industriais de purificação de metais, obtenção de reagentes, proteção contra corrosão, tratamento de água, na medicina e no combate à emissão de gases poluentes.
O que a eletroquímica estuda?
A eletroquímica é área da Química que estuda a conversão da energia química em elétrica, assim como a conversão de energia elétrica em energia química. O seu principal foco são as células galvânicas, também conhecidas como células voltaicas, dispositivos eletroquímicos comumente conhecidos como pilhas. Uma célula galvânica, ou o conjunto de células galvânicas ligadas em série entre si, também é chamada de bateria — utilizada para converter energia química em energia elétrica via reações espontâneas.
A eletroquímica também estuda os processos de eletrólise, que, ao contrário de uma célula galvânica, utiliza uma corrente elétrica para gerar uma reação não espontânea. A eletrólise é extremamente útil em processos de purificação e produção de metais, sendo amplamente empregada na metalurgia.
Além das células galvânicas e das eletrólises, a eletroquímica estuda os processos de corrosão e os métodos de proteção de metais contra a deterioração, como a passivação e a galvanização. Em geral, todos esses processos são baseados em reações que ocorrem com transferência de elétrons, também chamadas de reações oxirredução.
O que são reações de oxirredução?
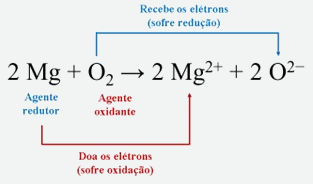
As reações de oxirredução, ou reações redox, são reações que ocorrem com transferência de elétrons. Um exemplo é a reação entre o magnésio metálico e o gás oxigênio:
2 Mg(s) + O2 → 2 MgO
Essa reação ocorre em duas etapas simultâneas, denominadas semirreação, que descreve o processo de transferência de elétrons.
→ Reação de oxidação
Processo em que um átomo cede elétrons, como descrito a semirreação de oxidação abaixo:
2 Mg(s) → Mg2+ + 4 e−
A semirreação de oxidação mostra que o magnésio metálico tem estado de oxidação zero no início da reação e que, ao perder dois elétrons, muda seu estado de oxidação para +2, no cátion Mg2+.
→ Reação de redução
Processo em que um átomo ganha elétrons, como descrito na semirreação de redução abaixo:
O2 + 4 e−→ 2 O2−
A semirreação de redução descreve o ganho de elétrons pelo átomo de oxigênio, que sai do estado de oxidação zero para −2, formando o ânion O2−.
O estado de oxidação dos átomos é definido como número de oxidação (Nox) e refere-se ao número de carga que um átomo teria em uma molécula, ou em um composto iônico, caso houvesse transferência completa de elétrons. Nas reações de oxirredução, um átomo influencia na transformação sofrida pelo outro, e essa relação é expressa na classificação dada a esses átomos nesse tipo de reação:
- Agente oxidante: é o átomo que recebe elétrons e sofre redução, causando oxidação no átomo que perde os elétrons.
- Agente redutor: é o átomo que cede elétrons e sofre oxidação, causando a redução no átomo que ganha os elétrons.
Essa relação pode ser descrita na reação tratada anteriormente, em que o magnésio atua como agente redutor, enquanto o oxigênio atua como agente oxidante, como descrito a seguir.
Principais conceitos da eletroquímica
Os principais conceitos desenvolvidos dentro da eletroquímica são os de células galvânicas, popularizadas pelo termo “pilha”; e de eletrólise, que passou a ser um processo fundamental na indústria. O entendimento geral do funcionamento das pilhas e da eletrólise é estabelecido por meio dos experimentos clássicos, discutidos a seguir.
→ Pilha de Volta
Em 1800, Alessandro Volta desenvolveu a primeiro dispositivo elétrico empilhando discos de zinco (Zn) e cobre (Cu) e separando-os por pedaços de papelão umedecidos por uma solução salina. Os discos eram conectados a fios metálicos, possibilitando a condução da corrente elétrica gerada no dispositivo, como mostra a figura abaixo.
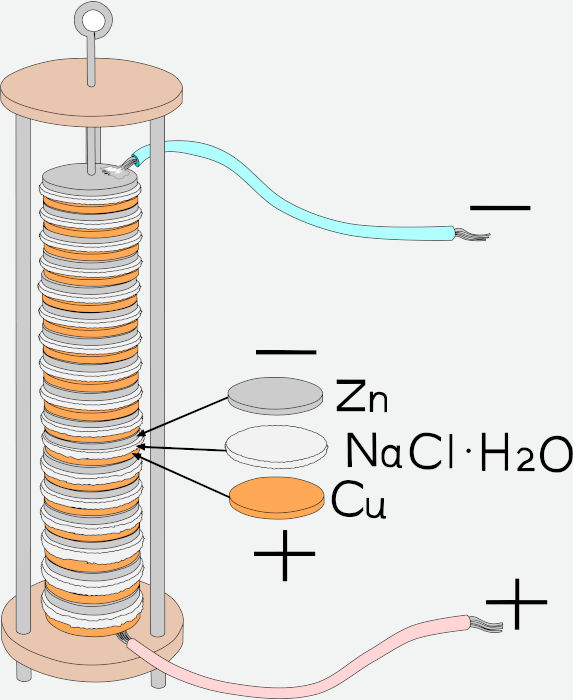
A pilha de Volta é formada por um conjunto de células galvânicas ligadas em série e suas extremidades são dois polos. A estrutura da pilha pode ser entendida da seguinte forma:
- Polo positivo (cátodo): é formado pelo disco de cobre (Cu), em que ocorre o processo de redução (ganho de elétrons).
- Polo negativo (ânodo): é formado pelo disco de zinco (Zn), em que ocorre o processo de oxidação (perda de elétrons).
- Solução eletrolítica: presente no papelão umedecido com solução salina ou ácida, funciona como uma ponte e permite que ocorra a condução da corrente elétrica através dos íons livres na solução.
O funcionamento da pilha consiste na oxidação do zinco que ocorre com a perda elétrons para o cobre, que sofre redução. Os elétrons fluem através da solução eletrolítica, gerando uma corrente elétrica orientada pelo fio condutor.
→ Pilha de Daniell
Em 1836, John Daniell desenvolveu um dispositivo com o intuito de resolver problemas de instabilidade na pilha de Volta. Esse dispositivo ficou conhecido como célula de Daniell ou pilha de Daniell. A célula desenvolvida por Daniell é formada por uma barra de zinco mergulhada em uma solução de sulfato de zinco (ZnSO4) e uma barra de cobre mergulhada em uma solução de sulfato de cobre (CuSO4).
As duas soluções são conectadas por uma ponte salina (um tubo em U invertido), que contém uma solução de KCl, em que as aberturas são fechadas com algodão para evitar que as soluções se misturem, como mostra a figura a seguir.
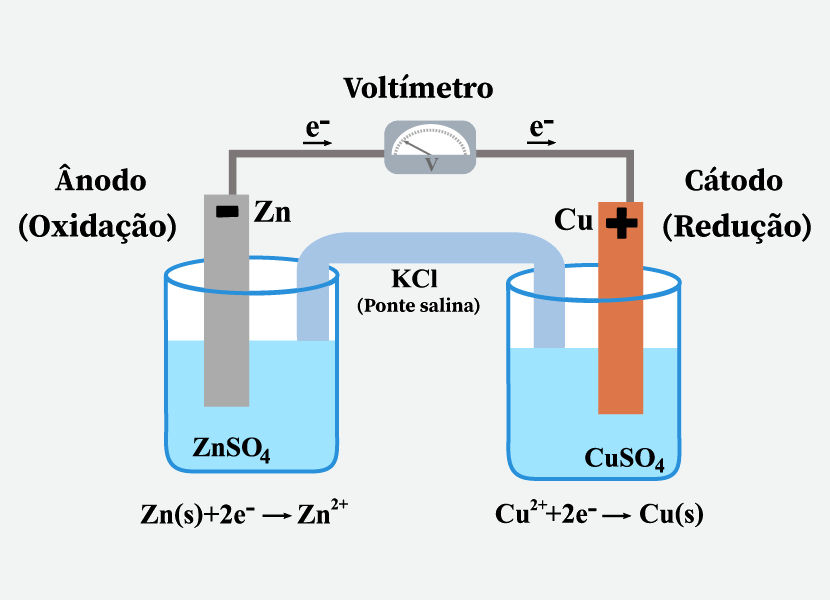
As barras de zinco e de cobre são chamadas de eletrodos e estão conectadas por um fio condutor pelo qual ocorre o fluxo de elétrons. Em uma célula galvânica, o eletrodo no qual ocorre a oxidação é chamado de ânodo e o eletrodo em que ocorre a redução é chamado de cátodo. As reações que ocorrem em cada eletrodo podem ser descritas pelas semirreações a seguir:
- Ânodo (polo negativo): ocorre a oxidação do zinco.
Zn(s) → Zn2+(aq) + 2 e−
- Cátodo (polo positivo): ocorre a redução do cobre.
Cu2+(aq) + 2 e− → Cu(s)
A reação também pode ser descrita pelo diagrama de célula, como descrito abaixo:
Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s)
A linha vertical representa um limite entre as fases, em que o eletrodo está na fase sólida e os íons em solução aquosa. O traço duplo indica a utilização de uma ponte salina. No diagrama, a célula é descrita do ânodo para o cátodo, considerando o deslocamento espontâneo dos elétrons.
→ Eletrólise
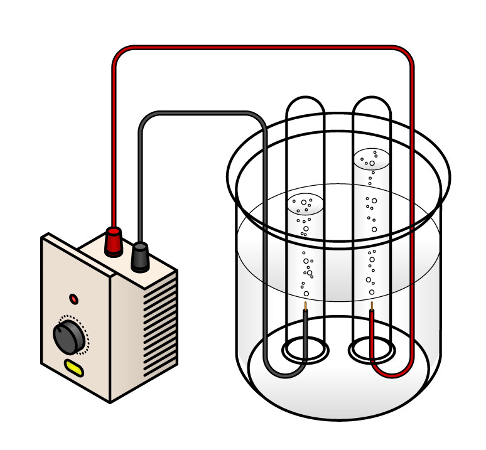
A eletrólise é um processo em que uma corrente elétrica externa é utilizada para gerar uma reação não espontânea. A reação ocorre em uma cuba eletrolítica e a corrente elétrica é produzida por um gerador de energia elétrica (pilha). Os eletrodos geralmente são inertes, feitos de platina ou grafite.
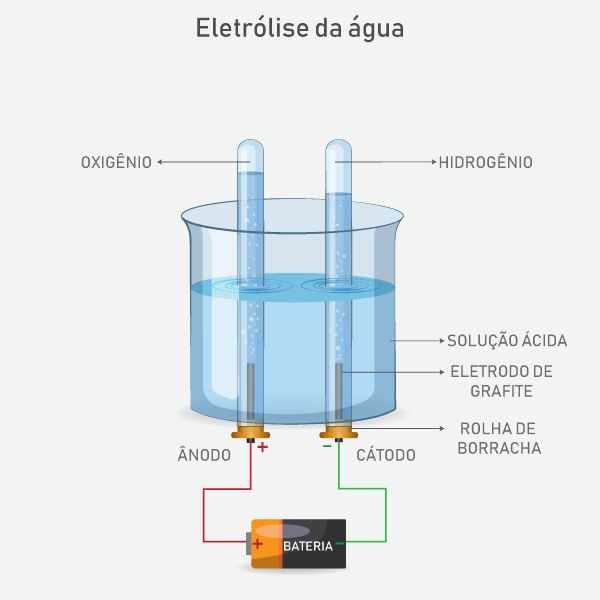
Para que ocorra a eletrólise, é necessário a presença de íon livres, que podem estar em estado fundido (eletrólise ígnea) ou aquoso (eletrólise aquosa).
-
Eletrólise ígnea
É realizada com base em uma substância fundida (que passou do estado sólido para o líquido após o aquecimento). Essa fundição é indispensável para liberar os íons da substância e viabilizar a movimentação de elétrons através do líquido. O cloreto de sódio (NaCl) é comumente utilizado em processos de eletrólise ígnea para obtenção de sódio metálico e gás cloro. O processo se inicia com a fusão do sal, gerando uma dissociação iônica dos seus íons:
2 NaCl(s) → 2 Na+(ℓ) + 2 Cl−(ℓ)
O processo de transferência de elétrons que ocorre na cuba eletrolítica pode ser descrito pelas seguintes semirreações:
-
- Cátodo (redução): 2 Na+(ℓ) + 2 e− → Na(s)
- Ânodo (oxidação): Cl−(ℓ) → Cl2(g) + 2 e−
A equação global que descreve o processo é obtida pela soma das duas semirreações:
-
- Reação global: 2 Na+(ℓ) + Cl−(ℓ) → Na(s) + Cl2(g)
-
Eletrólise aquosa
Ocorre por meio de uma solução eletrolítica da substância a ser eletrolisada. No processo em meio aquoso, é necessário considerar a autoionização da água que produz íon hidrogênio (H+) e íon hidróxido (OH−):
H2O(ℓ) → H+(aq) + OH−(aq)
Os íons originados da água competem com os íons da substância dissolvida. Assim, é fundamental conhecer em quais eletrodos ocorrerá a descarga dos íons hidrogênio e hidróxido e a fila de descarga dos íons da substância em relação aos íons da água, como ilustrado na figura a seguir:
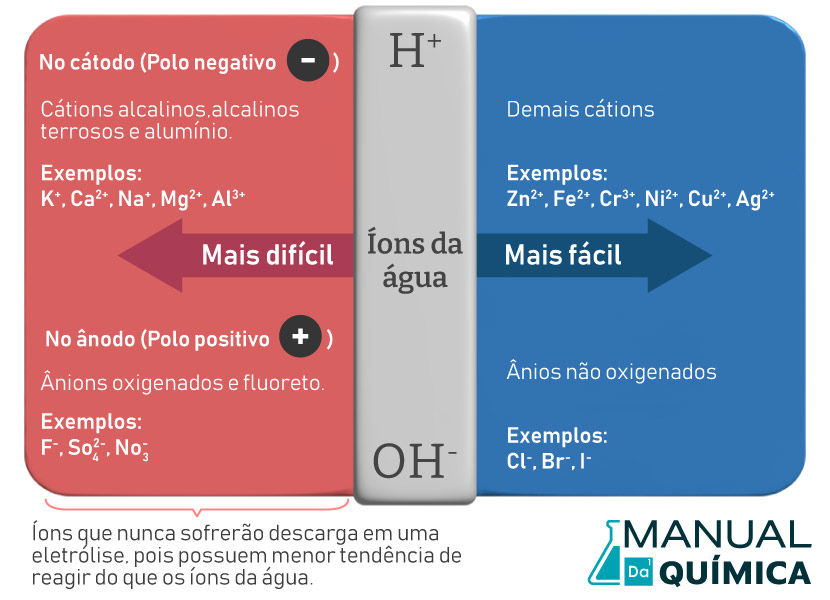
Diante disso, vamos considerar a eletrólise aquosa do NaCl, em que o meio eletrolítico será composto pelos íons do sal e da água, como descrito nas equações abaixo:
-
- Dissolução do NaCl: 2 Na+(ℓ) + Cl−(ℓ) → Na(s) + Cl2(g)
- Ionização da água: 2 H2O(ℓ) → 2 H+(aq) + 2 OH−(aq)
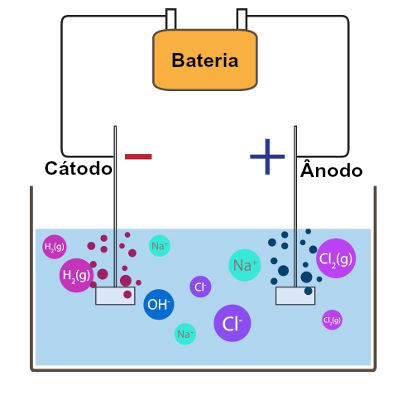
No cátodo, ocorre a descarga do íon H+ por apresentar maior tendência de redução do que o cátion Na+, e, no ânodo, ocorre a descarga do íon Cl− por apresentar maior tendência de oxidação do que o OH−, como mostram as semirreações abaixo:
-
- Cátodo (redução): 2 H+(aq) + 2 e− → H2(g)
- Ânodo (oxidação): 2 Cl− (aq) → Cl2(g) + 2 e−
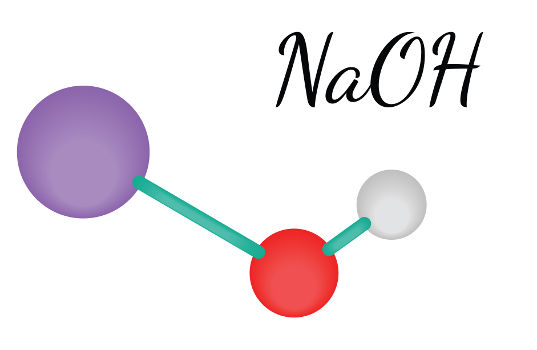
Além dos gases hidrogênio (H2) e cloro (Cl2), há formação do hidróxido de sódio (NaOH) a partir dos íons H+ e OH− presentes no meio aquoso. A equação global da eletrólise aquosa do cloreto de sódio pode ser descrita da seguinte forma:
2 NaCl(s) + 2 H2O(l) → 2 NaOH(aq) + H2(g) + Cl2(g)
→ Diferença de potencial
A diferença de potencial elétrico entre o cátodo e o ânodo é chamada de potencial da célula, força eletromotriz ou, simplesmente, fem (E). Comumente conhecida como d.d.p., a diferença de potencial é medida por um voltímetro e expressa em volts (V). A espontaneidade de uma reação de oxirredução é prevista com base no potencial padrão de redução (E°), que indica a tendência de uma espécie química receber elétrons, sofrendo redução, em condições padrão (T = 25 °C, P = 1 atm e concentração = 1 mol/L).
Os valores de E° são relativos e obtidos pelo eletrodo-padrão de hidrogênio (EPH), um eletrodo de referência com potencial-padrão de redução igual a zero. Os valores de E° são tabelados, e quanto mais o valor for positivo, maior será a tendência da espécie química sofrer redução.
-
Cálculo da d.d.p. de uma pilha
A diferença de potencial de uma pilha depende da natureza da reação da pilha e da concentração das espécies químicas que participam da reação. A d.d.p. pode ser obtida das seguintes formas:
E° = E°cátodo − E°ânodo ou E° = E°red maior − E°red menor
Para entender o desenvolvimento, vamos calcular a diferença de potencial da pilha de Daniell, descrita pelo diagrama seguir:
Zn(s) | Zn2+(aq, 1 mol/L) || Cu2+(aq, 1 mol/L) | Cu(s) (25 °C)
No cátodo, ocorre a redução do íon cobre, descrita na semirreação a seguir:
Cu2+(aq) + 2 e− → Cu(s) E° (Cu2+/Cu) = +0,34 V
No ânodo, ocorre a oxidação do zinco metálico, descrita na semirreação a seguir:
Zn(s) → Zn2+(aq) + 2 e− E° (Zn/Zn2+) = +0,76 V
É importante destacar que o valor do E° é referente ao processo de redução, porém o processo que ocorre no ânodo é o de oxidação (processo inverso). Diante disso, o valor de potencial (Zn/Zn2+) deve ser invertido para −0,76 V.
Assim, temos:
E° = E°cátodo − E°ânodo
E° = +0,34 V − (−0,76 V)
E° = +0,34 V + 0,76 V
E° = + 1,10 V
A equação global que descreve o processo pode ser descria da seguinte forma:
Zn(s) + Cu2+(aq) → Cu(s) + Zn2+(aq) E° = + 1,10 V
É importante destacar que o cálculo da d.d.p. também pode ser utilizado para determinar a eficiência da eletrólise, considerando que, para que a reação ocorra, é necessária uma voltagem maior que o E° da reação.
Veja também: O que é galvanoplastia?
Aplicações da eletroquímica
A eletroquímica apresenta várias aplicações no cotidiano e na indústria, sendo indispensável para o funcionamento da sociedade nos dias atuais. Entre essas aplicações, destacam-se:
- Pilhas e baterias: são dispositivos eletroquímicos utilizados para gerar energia e garantir o funcionamento de diversos aparelhos eletrônicos no dia a dia e na indústria.
- Combate à corrosão: a corrosão é um processo espontâneo caracterizado pela oxidação de metais que estão expostos ao oxigênio e à umidade do ambiente. Entre os métodos de proteção a corrosão, destacam-se a passivação e a galvanização.
- Purificação de metais: é realizada pela eletrólise, com o objetivo de se aumentar a pureza de certos metais, como o cobre e alumínio, utilizados na produção de fios.
- Produção de gases e outras substâncias: também é realizada via eletrólise, em que o processo ígneo possibilita a obtenção de metais e gases de interesse. Enquanto, no meio aquoso, é possível obter algumas bases muito úteis no dia a dia, como a soda cáustica (NaOH).
- Células a combustível: são alternativas aos processos de combustão usuais em veículos. A principal finalidade da célula a combustível é aumentar a eficiência do motor, além da diminuição de ruídos e poluição.
Qual a importância da eletroquímica?
A importância da eletroquímica está no fato de ela ser a base de funcionamento dos inúmeros dispositivos eletrônicos usuais do cotidiano, como celulares e computadores. Além disso, a eletroquímica tem se tornado uma alternativa para diminuição da poluição oriunda da queima de combustíveis fósseis. Nesse contexto, a eletrocatálise tem sido utilizada para converter gases poluentes em outras substâncias menos nocivas.
A eletroquímica também tem papel fundamental em processos de purificação de água, em que os métodos de eletrocoagulação e eletrodiálise são indispensáveis para remover metais pesados, corantes e outros poluentes da água.
Origem e história da eletroquímica
A história da eletroquímica começa a ser escrita no princípio da compreensão do fenômeno da eletricidade, durante o século XVI, junto aos estudos sobre o magnetismo e a eletricidade estática. Um dos percussores da eletroquímica foi o médico Luigi Galvani, que, em 1780, observou contrações em pernas de rãs mortas quando estas eram tocadas por superfícies metálicas. Galvani chamou esse fenômeno de “eletricidade animal”, uma força vital inata que até então era desconhecida.
A teoria da eletricidade animal ganhou opositores, tais como Alessandro Volta, que acreditava que a eletricidade era gerada por meio do contato de metais com soluções condutoras. Em 1800, Volta construiu o primeiro dispositivo eletroquímico, que mais tarde ficou conhecido como pilha de Volta.
O dispositivo era formado por discos de zinco e cobre empilhados de forma alternada, com papelões umedecidos com solução ácida entre os discos. A pilha de Volta foi um marco para o desenvolvimento científico da época e permitiu provar que a eletricidade era, de fato, gerada da combinação de metais e soluções condutoras.
Ainda em 1800, o químico Willian Nicholson tomou conhecimento dos estudos de Volta, mesmo antes de serem publicados, e, imediatamente, junto a Anthony Carlisle, utilizou uma pilha para eletrizar a água e diferentes soluções.
Eles observaram que em um polo ocorria a liberação de hidrogênio, enquanto, no outro, o oxigênio era liberado. O processo ficou conhecido como eletrólise, que consiste na decomposição de uma substância pela passagem de corrente elétrica.
Experimentos similares também foram feitos por Humphry Davy, ainda em 1800, que fez as mesmas observações apontadas por Nicholson e Carlisle. Esses experimentos marcaram o início dos processos de purificação de metais e nortearam os estudos de Humphry Davy, que concluiu, em 1807, que a produção de eletricidade em células eletrolíticas ocorre por meio de reações químicas entre o eletrólito e os metais, entre substâncias de cargas opostas.
Em 1834, Michael Faraday formulou as leis da eletrólise descrevendo quantitativamente como a corrente elétrica provoca reações químicas. Ele introduziu os termos íon e eletrodo e seus estudos se tornaram a base para o entendimento dos processos de eletrólise. Em 1836, John Daniell desenvolveu um dispositivo com o objetivo de obter uma corrente elétrica constante, diferentemente da pilha de Volta, que apresentava problemas de instabilidade e curta duração.
Os estudos de Daniell foram fundamentais para aprofundar o conhecimento sobre os processos envolvidos nas células e nas eletrolises. A pilha desenvolvia por Daniell foi importante para a implementação do telégrafo elétrico, um sistema de comunicação considerado de larga escala para época e que permitiu a comunicação entre polos industriais ou de exploração mineral que estavam geograficamente distantes.
Em 1884, Svante August Arrhenius apresentou a sua teoria sobre a dissociação de eletrólitos em água, que resulta na formação de íons e torna a solução condutora de eletricidade. No desenvolvimento dessa teoria, Arrhenius definiu como ácido toda substância que, em meio aquoso, libera íon hidrogênio (H+), e como base toda substância que, em meio aquoso, libera íons hidroxila (OH−).
A teoria ácido-base de Arrhenius foi um marco nos estudos de eletroquímica, pois possibilitou a compreensão dos fenômenos observados na eletrólise. Em 1903, Arrhenius foi agraciado com o Prêmio Nobel de Química em reconhecimento a sua teoria de dissociação eletrolítica, que permitiu avanços significativos no desenvolvimento da Química. Seus estudos não explicavam por que a diferença de potencial em células eletroquímicas variava com diferentes concentrações ou pela mudança dos metais envolvidos nos experimentos que eram desenvolvidos na época.
As respostas foram dadas, em 1888, por Walther Nernst, que, baseado na termodinâmica, utilizou a lei de difusão, proposta em 1855 por Adolf Fick, e a teoria de dissociação eletrolítica de Arrhenius para apresentar uma descrição quantitativa da cinética do mecanismo de difusão dos eletrólitos.
Nernst concluiu que existe uma força atuando em cada íon e essa força é proporcional ao gradiente de pressão osmótica, que gera uma dupla camada elétrica na interface entre duas regiões com diferentes concentrações. Isso afeta a mobilidade dos íons e provoca a diferença de potencial, chamada de “potencial de junção líquida”.
Em 1889, Nernst publicou aquela que ficaria conhecida por “equação de Nernst” e que estabelece a relação quantitativa que possibilita determinar a força eletromotriz (FEM) de uma pilha em diferentes concentrações de íons. Os estudos de Nernst apresentaram descrições do comportamento dos eletrodos em diferentes condições e permitiram a criação da tabela de potenciais-padrão de redução, essencial para prever a espontaneidade das reações eletroquímicas.
Este tópico foi um breve resumo do desenvolvimento dos principais conceitos que são hoje a base da eletroquímica.
Saiba mais: Como fazer o balanceamento de equações de oxirredução
Exercícios resolvidos sobre eletroquímica
Questão 1: (Enem) O quadro lista alguns dispositivos eletrônicos que estão presentes no dia a dia, bem como a faixa de força eletromotriz necessária ao seu funcionamento.
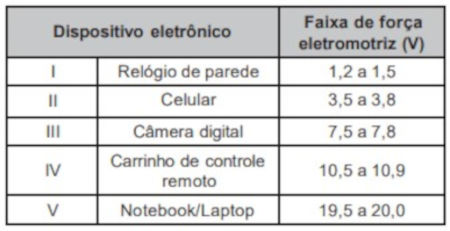
Considere que uma bateria é construída pela associação em série de três pilhas de lítio-iodo, nas condições-padrão, conforme as semiequações de redução apresentadas.
I2 + 2 eー → 2 Iー E° = +0,54 V
Li+ + eー → Li E° = −3,05 V
Essa bateria é adequada para o funcionamento de qual dispositivo eletrônico?
A) I
B) II
C) III
D) IV
E) V
Resposta: D.
Resolução comentada: Para saber em qual dispositivo eletrônico essa bateria pode ser utilizada, é necessário calcular a d.d.p. da pilha de lítio-iodo por meio das semirreações de redução que foram dadas.
I2 + 2 eー → 2 Iー E° = +0,54 V
Li+ + eー → Li E° = −3,05 V
A d.d.p. pode ser dada por:
∆E° = E°red maior − E°red menor
Substituindo os valores do E° de cada reação, temos:
∆E° = +0,54 − (−3,05)
∆E° = +3,59 V
Atente ao fato de que a bateria é formada por três pilhas em série; logo, o valor de d.d.p. é multiplicado por três.
3 x 3,59 V = +10,77 V
Dessa forma, essa bateria será adequada para o carrinho de controle remoto, que utiliza uma força eletromotriz (V) em uma faixa de 10,5 a 10,9 V.
Questão 2: (Enem) Pesquisadores da Universidade de Wisconsin-Madison, nos Estados Unidos, desenvolveram um dessalinizador-pilha. O invento se mostrou muito promissor para dessalinizar água do mar, empregando eletrodos com bismuto e titânio em suas composições. Para realizar a dessalinização, o dispositivo funciona por eletrólise, conforme a figura. No descarregamento do dispositivo ocorre o processo inverso, que permite reaproveitar a energia, como em uma pilha.
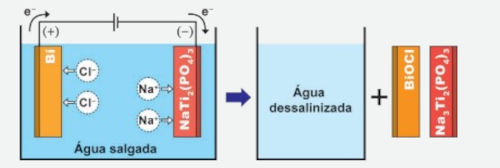
NAM, D.-H.; CHOI, K.-S. Bismuth as a New Chloride-Storage Electrode Enabling the Construction of a Practical High Capacity Desalination Battery. Journal of the American Chemical Society, n. 139, 2017 (adaptado).
Durante a dessalinização da água por eletrólise, ocorre a formação de
A) BiOCl no ânodo.
B) H2 (g) no cátodo.
C) Bi no polo positivo.
D) O2 (g) no polo negativo.
E) Na3Ti2(PO4)3 no ânodo.
Resposta: A.
Resolução comentada: A questão trata de um processo de eletrólise e a figura ilustra o sistema antes e depois da eletrólise.
A pergunta é direcionada para os produtos formados nesse processo (representados após a seta). Observe que os únicos produtos formados nessa reação de eletrólise são o BiOCl e o Na3Ti2(PO4)3. Para determinar a alternativa correta, é necessário analisar os polos dos eletrodos. Lembre-se de que a eletrólise é um processo não espontâneo e apresenta os polos dos eletrodos invertidos, quando comparados a uma pilha.
O esquema mostra que o eletrodo de bismuto (Bi) é o polo positivo (+), tratando-se do ânodo.
O eletrodo de titânio (NaTi2(PO4)3) é polo negativo (−), tratando-se do cátodo. Dessa forma, a única alternativa que relaciona corretamente o produto formado com o respectivo polo do eletrodo é alternativa A.
Fontes
ATKINS, Peter; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente; 3ª ed.;Porto Alegre; Bookman; 2006.
ATKINS, P. W. PAULA, J. de. Fundamentos de Físico-Química. Vol 1 & 2. 5 ed. Rio de Janeiro: LTC, 2003.
BASSINI, A. Pilha de Volta. CienTec-USP, 2020. Disponível em: https://www.parquecientec.usp.br/passeio-virtual/brinquedos-de-fisica/pilha-de-volta
CHANG, Raymond. Química Geral: Conceitos Essenciais; 4ªed.; São Paulo;McGraw-Hill;2007.
COSTA, M. C. S.; PORTO, P. A. A pilha de Daniell: um estudo de caso histórico. Caderno Brasileiro de Ensino de Física, v. 38, n. 3, p. 1650-1673, 2021.
SILVA, D. C., BORGES, E. A equação de Nernst: origens e contexto termodinâmico, Quím. Nova, v. 48, n. 2, p. 1-9, 2025.
STOCK, J. T. Electrochemistry in Retrospect, American Chemical Society, v. 390, 1989 (Online, 2011).
TOLENTINO, M., ROCHA-FILHO, R. C. O bicentenário da invenção da pilha elétrica. Quím. Nova Esc., v. 11, 2000.