Termoquímica
A termoquímica é um ramo da Química que aplica leis da termodinâmica para entender a quantidade de calor transferida em processos químicos.
Por Stéfano Araújo Novais

PUBLICIDADE
A termoquímica é uma área da Química em que são aplicadas leis da termodinâmica. É por meio da termoquímica que se estuda a energia transferida, na forma de calor, durante uma reação química. No caso da termoquímica, entende-se que o sistema termodinâmica é composto pelo local onde ocorre a reação química.
A termoquímica utiliza da entalpia, uma grandeza associada à energia interna, para determinar a quantidade de calor absorvida ou liberada em uma reação química. Dessa forma, existem várias formas para se calcular a variação de entalpia, como, por exemplo, a Lei de Hess, ou por meio de fórmulas mais simples. A termoquímica é de grande interesse para o desenvolvimento de produtos muito aplicados no nosso cotidiano, como os combustíveis.
Leia também: Como calcular a energia de ligação em uma reação química?
Resumo sobre termoquímica
- A termoquímica é o estudo da quantidade de energia transferida, na forma de calor, durante uma reação química.
- É uma das principais aplicações da termodinâmica na Química.
- O calor envolvido em uma reação química pode ser calculado pela utilização de uma grandeza termodinâmica conhecida como entalpia.
- A variação de entalpia em pressão constante é numericamente igual à variação de calor.
- A variação de entalpia pode ser calculada de diversas formas, por exemplo, como pela Lei de Hess.
- A termoquímica tem grande aplicabilidade na sociedade, a exemplo do setor de combustíveis e energia.
Videoaula sobre termoquímica
O que é termoquímica?
A termoquímica é uma das principais aplicações da termodinâmica na Química, consistindo no estudo da energia transferida, na forma de calor, durante uma reação química. Entende-se que a termoquímica é um campo da termodinâmica, porque os locais onde ocorrem as reações, como os frascos de laboratório, ou até mesmo os reatores industriais, bem como o seu conteúdo (substâncias químicas) compõem um sistema e, é claro, a reação química resulta em uma troca de energia entre o sistema e a sua vizinhança.
O que é entalpia?
A definição de entalpia, comumente representada pela letra H, não é tão simples quanto se parece. Mas, para resumir, pode-se dizer que a entalpia é uma ferramenta para calcular a energia fornecida ou desprendida na forma de calor, em uma reação química.
Em tese, a troca de calor que ocorre entre uma reação química e sua vizinhança pode ser medida por um calorímetro, porém a entalpia também nos fornece esse dado por meio de uma consequência de sua definição e relação com a variação da energia interna (U) do sistema.
A variação de energia interna não funciona para definir a variação de calor do sistema. Suponha-se que haja um sistema cilíndrico contendo um gás e um êmbolo sob pressão constante. Se esse sistema absorver calor, parte desse calor pode ser fornecido pode escapar como trabalho de expansão (para fazer o êmbolo subir). Nesse caso, a variação de energia interna é menor do que a quantidade de calor absorvida, ou seja, ΔU < q. Não à toa, a energia variação de energia interna é definida como:
ΔU = Δq + Δw (1)
Nessa expressão, “q” é o calor envolvido e “w” é o trabalho exercido.
É nesse momento que entra a relação entre entalpia e calor. A termodinâmica define entalpia da seguinte forma:
H = U + pV (2)
Já a variação de entalpia é dada por:
ΔH = ΔU + ΔpΔV (3)
Se a troca de energia ocorrer em pressão constante, podemos reduzir a expressão (3) para a seguinte forma:
ΔH = ΔU + pΔV (4)
Na mesma situação anteriormente descrita, em que temos um gás embutido em um cilindro com êmbolo, a absorção de calor pelo sistema desenvolve um trabalho de expansão sob pressão constante. Nesse caso, como o êmbolo atua contra a pressão externa, podemos dizer que o trabalho de expansão é:
Δw = −pΔV (5)
Substituindo-se a expressão (1) e (5) em (4), temos que:
ΔH = Δq + Δw + pΔV
ΔH = Δq − pΔV + pΔV
E, portanto:
ΔH = Δq
Conseguimos, portanto, comprovar que, para uma reação química que ocorra em pressão constante (praticamente todas), a variação de entalpia é numericamente igual à variação de calor. Portanto, a entalpia não é o calor em si, mas sim uma função termodinâmica, associada à energia interna do sistema, cuja variação, sob a condição de pressão constante, é numericamente igual à variação de calor do sistema.
Veja também: O que é a entropia?
Qual a fórmula da termoquímica?
A entalpia de forma isolada não possui muita importância para a termoquímica. De fato, o valor importante é a sua variação, que pode ser definida da seguinte forma:
ΔH = Hfinal – Hincial
Ou seja, a variação de entalpia é definida como a diferença entre o valor da entalpia do estado final em relação ao estado inicial. De fato a variação é mais importante que o valor absoluto da entalpia, uma vez que estamos interessados em avaliar a transferência de energia, na forma de calor, entre sistema e vizinhança, em dois momentos diferentes (no começo e no fim da reação da química).
Se pensarmos nos produtos como o estado final de uma reação química e nos reagentes como o estado inicial de uma reação química, podemos definir a variação de entalpia como:
ΔH = Hprodutos – Hreagentes
Quais os tipos de reações termoquímicas?
A variação da entalpia pode ser tanto positiva quanto negativa. Se a variação da entalpia for positiva (ΔH > 0), é possível dizer que houve acréscimo na quantidade de calor do sistema, o que quer dizer que o sistema (reação) absorveu calor da vizinhança. Nesse caso, dizemos que o processo é endotérmico. Um exemplo de reação endotérmica é a fotossíntese, que consiste no processo de produção de alimentos para plantas, por meio da absorção de energia.
Se a variação de entalpia por negativa (ΔH < 0), é possível dizer que houve uma perda na quantidade de calor do sistema, o que quer dizer que o sistema (reação) desprendeu calor para a vizinhança. Nesse caso, dizemos que o processo é exotérmico. As combustões são os maiores exemplos de reações exotérmicas.
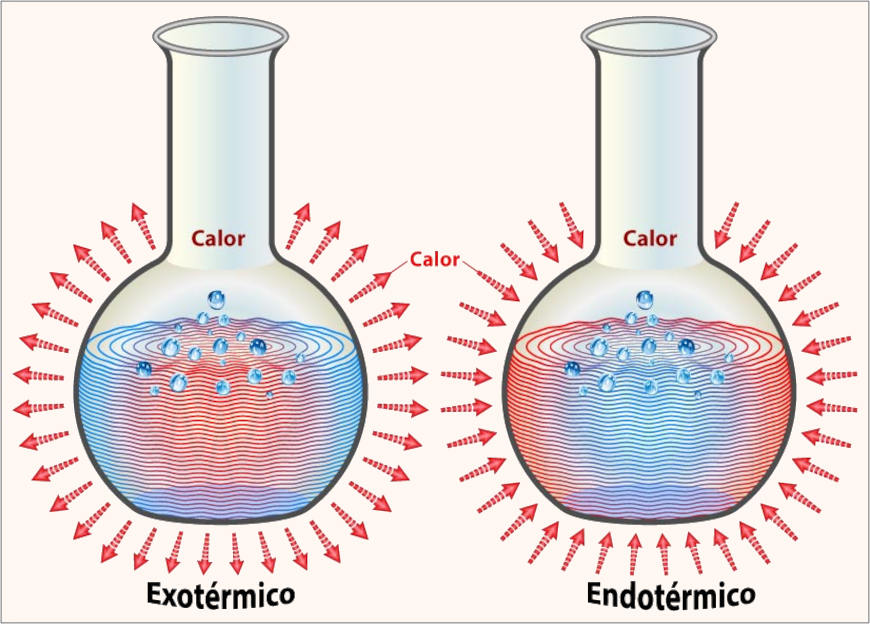
Equação termoquímica
As equações termoquímicas possuem como função a representação de reações químicas, demonstrando também aspectos relacionados à quantidade de calor envolvida. Por isso, equações termoquímicas vêm acompanhadas dos valores de variação de entalpia ou da quantidade de calor transferida durante a reação.
O sistema internacional de unidade estabelece o joule (J) como unidade para energia (e, consequentemente, o calor). Portanto, os valores de entalpia e calor serão acompanhados da unidade J, ou de suas unidades proporcionais, como o quilojoule (kJ). Também é possível expor os valores de energia e entalpia em calorias (cal), onde 1 caloria é equivalente a 4,184 J.
A equação termoquímica para uma reação endotérmica pode ser feita das seguintes formas:
CaCO3 (s) + 178 kJ → CaO (s) + CO2 (g) ou
CaCO3 (s) → CaO (s) + CO2 (g) ΔH = +178 kJ/mol CaCO3
Já a equação termoquímica para um processo exotérmico pode ser representada pelas duas formas a seguir:
C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O + 1367 kJ ou
C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O ΔH = −1367 kJ/mol C2H5OH
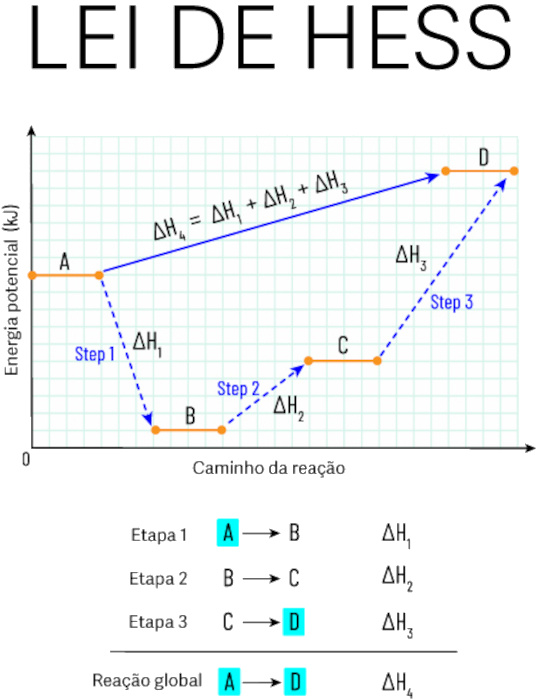
Lei de Hess
A lei de Hess permite o cálculo da variação de entalpia de uma determinada reação química através da combinação de reações cuja variação de entalpia é conhecida. É uma consequência da primeira lei da termodinâmica e pode ser enunciada da seguinte maneira:
| A entalpia padrão de uma reação é o resultado do somatório dos valores de reações individuais nas quais esta reação pode ser dividida. |
Outro ponto importante é que as reações individuais não precisam ser realizadas na prática, o que quer dizer que elas podem ser reações meramente hipotéticas. O único requisito é que suas equações químicas estejam devidamente balanceadas.
A lei de Hess é consequência da ideia de independência de caminho para a obtenção da variação de entalpia. Ou seja, dada uma reação hipotética A → B, não interessa como essa reação se desenvolveu, quantas etapas reacionais ela utilizou, apenas que o estado inicial é “A” e o estado final é “B”.
Observe o gráfico abaixo, que exemplifica a lei de Hess. Perceba que a variação de entalpia de A até D é o somatório dos processos intermediários (A para B; B para C; C para D):
Vejamos um exemplo:
A reação de hidrogenação do propeno possui uma entalpia padrão de reação igual a −124 kJ/mol:
C3H6 (g) + H2 (g) → C3H8 (g) ΔH = −124 kJ/mol
Já a combustão do propano possui uma entalpia padrão de reação igual a −2220 kJ/mol:
C3H8 (g) + 5 O2 (g) → 3 CO2 (g) + 4 H2O (l) ΔH = −2220 kJ/mol
Já a reação de formação da água apresenta a entalpia padrão de reação igual a −286 kJ/mol:
H2 (g) + ½ O2 (g) → H2O (l) ΔH = −286 kJ/mol
Com essas reações, é possível determinar a entalpia padrão da reação de combustão do propeno:
C3H6 + 9/2 O2 (g) → 3 CO2 (g) + 3 H2O (l)
Para isso, basta que se somem as reações de entalpia conhecidas, tal qual um sistema matemático:
C3H6 (g) + H2 (g) → C3H8 (g) ΔH = −124 kJ/mol
C3H8 (g) + 5 O2 (g) → 3 CO2 (g) + 4 H2O (l) ΔH = −2220 kJ/mol
H2O (l) → H2 (g) + ½ O2 (g) ΔH = +286 kJ/mol
_________________________________________________________________________
C3H6 + 9/2 O2 (g) → 3 CO2 (g) + 3 H2O (l) ΔH = −2058 kJ/mol
Como tratamos as equações químicas como equações matemáticas em um sistema, é possível fazer simplificações (cortes) a partir de operações, como multiplicações, divisões e inversão de sentido da reação. Repare que a reação de formação da água foi invertida. Isso ocorreu pelos seguintes motivos:
- para que o único mol de H2 (g) da reação de hidrogenação do propeno fosse eliminado por meio do mol de H2 (g) da reação de formação da água, já que na combustão do propeno ele não aparece;
- havendo 5 mols de O2 (g) na reação de combustão do propano, o 0,5 mol de O2 (g) da reação de formação da água, estando em um lado oposto, subtraiu essa quantidade dos 5 mols de O2 (g), resultando em 4,5 mols de O2 (g), necessários para a combustão do propeno;
- o único mol de H2O (l) da reação de formação da água, estando em lado oposto aos 4 mols de H2O (l) da reação de combustão do propano, fez com que a quantidade final fosse de 3 mols de H2O (l) do lado dos produtos, conforme o necessário na combustão do propeno.
Termoquímica no dia a dia
No dia a dia, as principais aplicações da termoquímica estão associadas aos campos de combustíveis e de alimentação. Embora haja um grande avanço dos veículos elétricos, boa parte dos meios de transporte, seja ele rodoviário, aquaviário ou aéreo, ainda utilizam motoros à combustão. O que quer dizer que a energia utilizada para seu funcionamento, é consequência de uma reação de combustão.
A termoquímica auxilia na determinação da energia envolvida em cada processo. No caso dos veículos flex, que podem ser movidos à etanol ou gasolina, o rendimento energético de cada combustível, acaba sendo utilizado para determinar, inclusive, o valor final do combustível para chamar a atenção do consumidor.
Por exemplo, estima-se que o etanol seja economicamente mais viável para o consumidor se ele custar até 70% do valor da gasolina. Isso porque o etanol tem cerca de 70% do poder calorífico da gasolina. Ou seja, se um trajeto consome 1 litro de etanol, o mesmo trajeto consumiria 700 mL de gasolina. Essas estimativas são obtidas por meio dos dados termoquímicos de cada combustível.
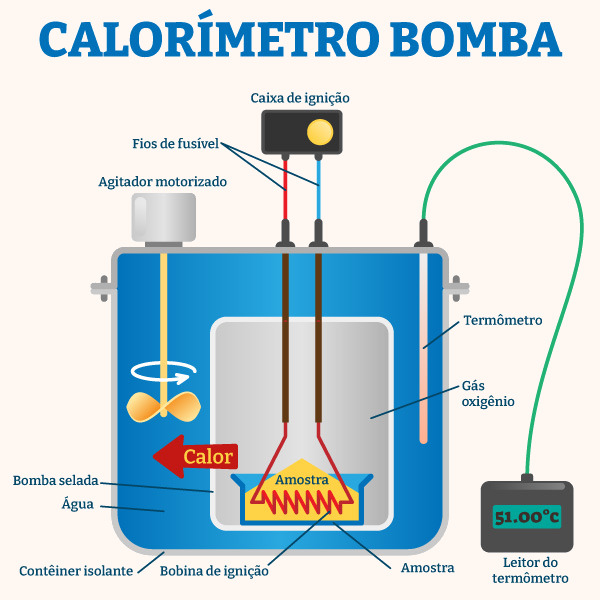
No campo alimentício, a energia dos alimentos, cuja informação é obrigatória em rótulos, é determinada por meio da calorimetria em um aparelho conhecido como calorímetro bomba. Nessa técnica, amostras dos alimentos sofrem uma combustão completa. O calor gerado nessa reação faz aquecer uma massa de água que está em volta. A variação da temperatura é utilizada para mensurar as calorias dos alimentos.
Qual a importância da termoquímica?
A termoquímica é a aplicação da termodinâmica, uma das principais áreas da física, na química. É a aplicação das leis fundamentais da termodinâmica em processos químicos, possibilitando mensurar o calor envolvido em todos os processos químicos.
Conhecer a variação de entalpia das reações permite um melhor dimensionamento dos processos na indústria, permitindo otimização, consumo mais consciente e melhor aproveitamento de energia. Nas discussões sobre processos mais ambientalmente sustentáveis, em que se busca mais economia de energia, os dados obtidos pela termoquímica servem de base para justificar pesquisas e desenvolvimento de novas tecnologias.
Saiba mais: Quais as vantagens e as desvantagens dos combustíveis fósseis?
Exercícios resolvidos sobre termoquímica
Questão 1. (UECE 2ª Fase 2º dia/2024.2) Atente para o seguinte enunciado sobre termoquímica e assinale a opção que preenche as lacunas corretamente.
Termoquímica é a área da Química que estuda a ______________1, na forma de calor, envolvida nas reações químicas. As ______________2 são representadas nas equações termoquímicas através da variação de ______________3. A absorção de calor indica que uma reação é ______________4. Já uma reação ______________5 libera calor na formação de novas substâncias.
A) entalpia1, trocas de energia2, entropia3, exotérmica4, endotérmica5
B) energia1, trocas de calor2, entalpia3, endotérmica4, exotérmica5
C) entropia1, trocas de calor2, entalpia3, exotérmica4, endotérmica5
D) energia1, trocas de energia2, entropia3, endotérmica4, exotérmica5
Resposta: Letra B.
A termoquímica estuda a transferência de energia, na forma de calor, que ocorre em reações químicas. As equações termoquímicas representam as trocas de calor que ocorrem nas reações químicas, sendo utilizada a variação de entalpia para a determinação dessas trocas de calor. Uma variação de entalpia positiva indica que o processo é endotérmico, ou seja, absorveu calor. Do contrário, uma variação de entalpia negativa indica que o processo é exotérmico, ou seja, liberou calor.
Questão 2. (UEA Geral/2023) O fogão a lenha, utilizado para preparação dos alimentos em muitas moradias, é considerado um patrimônio cultural no Brasil.

(https://ecofogao.com. Adaptado.)
A queima da lenha corresponde à reação de combustão das substâncias presentes em sua composição. A reação de combustão é um processo:
A) endotérmico, e sua variação de entalpia, ΔHº, tem valor maior do que zero.
B) exotérmico, e sua variação de entalpia, ΔHº, tem valor igual a zero.
C) endotérmico, e sua variação de entalpia, ΔHº, tem valor igual a zero.
D) exotérmico, e sua variação de entalpia, ΔHº, tem valor menor do que zero.
E) exotérmico, e sua variação de entalpia, ΔHº, tem valor maior do que zero.
Resposta: Letra D.
Toda reação de combustão é exotérmica, pois a combustão sempre libera calor. Dessa forma, a variação de entalpia é negativa (menor que zero).
Fontes
ATKINS, P.; DE PAULA, J.; KEELER, J. Physical Chemistry. 11. ed. Oxford: Oxford University Press, 2018.
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
CASTELLAN, G. Fundamentos de Físico-Química. 1. ed. Barueri: LTC Editora, 1986.
CNN BRASIL. ANP: etanol é mais competitivo em relação à gasolina em 7 estados e no DF. CNN Brasil. 20 jan. 2025. Disponível em: https://www.cnnbrasil.com.br/economia/macroeconomia/anp-etanol-e-mais-competitivo-em-relacao-a-gasolina-em-7-estados-e-no-df/
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
TANNUS, A. F. S. et. al. Determinação do valor energético por calorimetria direta de alguns alimentos consumidos por crianças e adolescentes. Revista de Nutrição. v. 14, n. 3, p. 231-233, set./dez. 2001