Cálculo da massa atômica
Para realizar o cálculo da massa atômica, você deve conhecer os isótopos do elemento, os números de massa de cada isótopo e sua abundância.
Por Diogo Lopes Dias

PUBLICIDADE
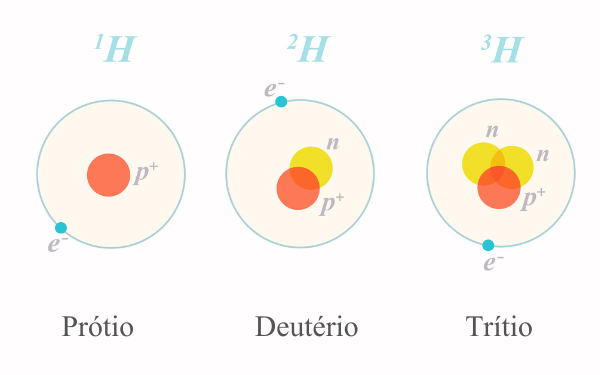
O cálculo da massa atômica é importante porque todo elemento químico apresenta isótopos (átomos de mesmo número atômico e diferentes números de massa), por isso, não podemos afirmar a massa de nenhum isótopo com base na massa presente na Tabela Periódica.
A massa atômica presente na Tabela Periódica é o resultado de um cálculo que envolve todos os isótopos existentes de um determinado elemento químico. Para a realização desse cálculo, é fundamental conhecermos as três variáveis fundamentais:
-
Isótopos do elemento;
-
Números de massa de cada isótopo;
-
Abundância de cada isótopo.
→ Passo a passo para o cálculo da massa atômica
-
1º Passo: multiplicação da massa do isótopo pela sua abundância.
Nesse primeiro passo do cálculo da massa atômica, devemos pegar a massa de cada um dos isótopos que o exercício fornecer e multiplicar pela abundância (porcentagem) de cada.
-
2º Passo: soma dos resultados das multiplicações do passo 1.
Após as multiplicações da massa atômica de cada isótopo pela sua abundância, devemos somar os resultados.
-
3º Passo: dividir o resultado da soma.
Por fim, o cálculo da massa atômica de um elemento é encerrado pela divisão do resultado da soma calculada no passo 2 por 100.
M.A. = Soma
100
→ Exemplos
Exemplo: Calcule a massa atômica do Ferro e considere os dados a seguir:
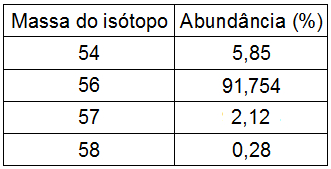
O exemplo fornece a massa e abundância de cada um dos isótopos do Ferro. Para calcular a massa atômica do Ferro, basta executar os seguintes passos:
-
Passo 1: multiplicação da massa pela abundância de cada isótopo.
Isótopo 54: 54.5,85 = 315,9
Isótopo 56: 56.91,754 = 5138,224
Isótopo 57: 57.2,12 = 120,84
Isótopo 58: 58.0,28 = 16,24
-
Passo 2: soma dos resultados das multiplicações entre a massa e a abundância de cada isótopo.
Soma = 315,9 + 5138,224 + 120,84 + 16,24
Soma = 55391,204
-
Passo 3: divisão da soma dos resultados das multiplicações por 100:
M.A. = 5591, 204
100
M.A. = 55, 91204 u
Aproveite para conferir as nossas videoaulas sobre o assunto: