Entropia
Entropia é a medida da desordem de um sistema. Para organizá-lo, é necessária a realização de trabalho.
Por Diogo Lopes Dias
PUBLICIDADE
O físico Rudolf Julius Emanuel Clausius, no ano de 1854, propôs a ideia de que uma reação química somente seria considerada espontânea se nela houvesse um aumento na desordem do sistema reacional, ou seja, quanto maior a desordem dos átomos presentes em uma reação, mais espontânea ela é.
Foi assim que surgiu o conceito de Entropia. Segundo Clausius, ela é uma medida física da desordem (desorganização) de um sistema, sendo representada pela letra S. O entendimento da entropia pode ser facilitado pelas imagens a seguir:
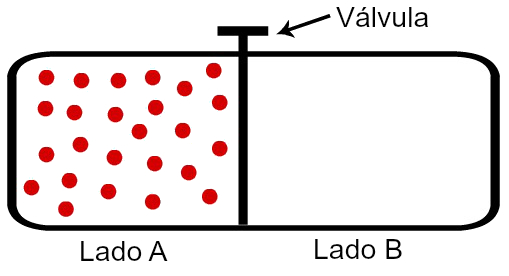
Sistema A com moléculas isolado do sistema B
Podemos observar na imagem que o lado A está isolado do lado B (onde temos vácuo) por meio de uma válvula. O lado A apresenta certa quantidade de gás, mas as moléculas encontram-se aprisionadas (com menor movimentação) nessa região. Veja o que acontece quando permitimos a comunicação entre ambos os lados:
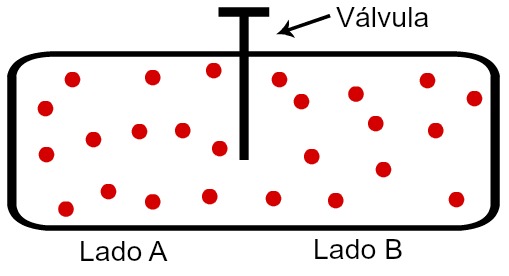
Aumento da desordem após a abertura da válvula do sistema
Ao abrir a válvula, permitimos que as moléculas do gás dispersem-se também para o lado B. Se as moléculas estão mais espalhadas, quer dizer que o sistema está mais desorganizado; logo, houve um aumento da entropia do sistema. Se houve aumento da entropia, o sistema tende a ser mais espontâneo.
Um dado relevante é que, como houve o aumento da entropia porque as moléculas do gás espalharam-se, aumentando a desordem, para organizá-las novamente no lado A do recipiente, obrigatoriamente deve ser realizado trabalho. Assim, a entropia de um sistema só pode ser diminuída mediante a realização de trabalho sobre ele.
Observação: Juntamente à entropia, a variação da entalpia de um sistema também pode determinar se ele é espontâneo, mas essa variação deve ser negativa (menor que zero).
Vale ressaltar que não é possível medir a entropia de um sistema químico ou físico, mas, sim, a variação da entropia de um sistema. Essa variação é calculada a partir da seguinte expressão matemática:
ΔS = Sp - Sr
ΔS = variação da entropia;
Sp = entropia dos produtos;
Sr = entropia dos reagentes.
A unidade de medida utilizada para a variação da entropia é cal/K.mol. Vamos acompanhar um exemplo de determinação da variação da entropia de uma reação representada pela equação:
C2H2 + 2 H2 C2H6 apresenta: ΔSC2H2 = 48 cal/K.mol, ΔSH2 = 31,2 cal/K.mol e ΔSC2H6 = 54,8 cal/K.mol. Podemos calcular sua variação de entropia assim:
ΔS = (54,8) – [48 + 2.(31,2)]
ΔS = 54,8 – [48 + 62,4]
ΔS = 54,8 -110,4
ΔS = - 55,6 cal/K.mol
Temos nesse exemplo uma reação química que se processa por meio de um ΔS menor do que zero. Por isso, podemos afirmar que sua entropia é baixa, pois, para que a entropia seja alta, o ΔS deve ser maior do que zero. Se a entropia é baixa, podemos supor que se trata de um processo não espontâneo.
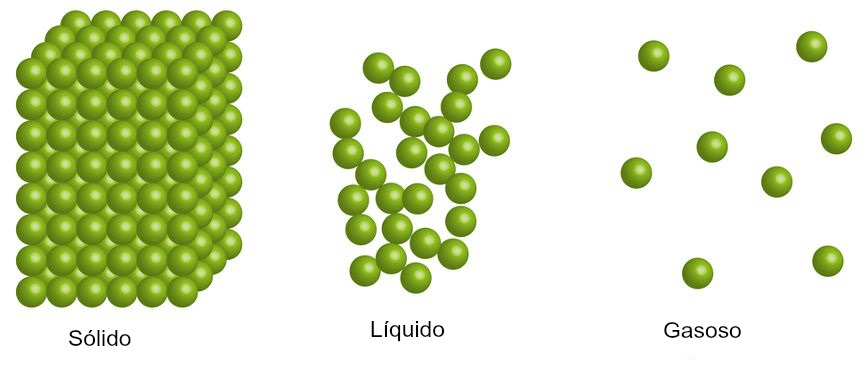
Outra forma de avaliarmos a entropia de um sistema sem utilizar cálculo é por meio da análise do estado físico dos participantes, já que, no estado gasoso, as moléculas não possuem agregação (muita movimentação, alta desordem e, logo, alta entropia) e, no estado sólido, há alta agregação entre as moléculas (pouca movimentação, muita organização e baixa entropia). Dessa forma:
S do gás > S do líquido > S do sólido
Em uma equação química, podemos estudar a entropia apenas relacionando os estados físicos dos reagentes e produtos. Acompanhe alguns exemplos:
a) 4Fe(s) + 3O2(g) → 2Fe2O3(s)
Nesse processo, houve uma diminuição na entropia porque há um reagente gasoso e, no produto, uma substância sólida, o que diminui a desordem do sistema.
b) H2O(s) → H2O(l)
Esse processo possui uma entropia maior do que zero porque há sólido no reagente e líquido no produto, ou seja, houve aumento na desordem e na entropia.
c) CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Não houve mudança no estado físico dos reagentes e produtos, logo, não é possível avaliar a entropia.
d) Cu2S(s) → 2Cu(s) + S(s)
Não houve mudança no estado físico dos reagentes e produtos, logo, não é possível avaliar a entropia.
e) S(s) + O2(g) → SO2(g)
Houve um aumento na desordem porque há, no reagente, um material sólido e, no produto, um gás.
Por Me. Diogo Lopes Dias







