Entalpia
Entalpia é uma grandeza calculada para prever se uma reação é energicamente favorável ou não. Também informa a quantidade de energia envolvida em processos químicos.
Por Jhonilson Pereira Gonçalves

PUBLICIDADE
Entalpia é a medida da energia total contida em um sistema, a qual pode ser liberada ou absorvida durante um processo. A palavra entalpia é derivada do grego, enthalpein, que significa “aquecer”. Diante disso, o termo foi introduzido na Química por volta de 1875 pelo físico alemão Wilhelm Ostwald. Tornou-se um conceito fundamental na Química e na Física, relacionado com a termodinâmica, a ciência que estuda as trocas de energia.
Nesse contexto, imagine uma fogueira, em que a queima da madeira na presença de oxigênio se dá inicialmente pelo fornecimento de energia, que logo gera uma reação de combustão. Nesse tipo de reação, a quebra das ligações do material queimado libera energia em forma de calor (nas chamas), além de produtos como dióxido de carbono e água.
Desse modo, podemos dizer que a entalpia desse tipo de reação envolve a liberação de energia. Contudo, vale ressaltar que esse conceito não se limita apenas ao calor, embora, muitas vezes, seja associado a ele, mas abrange todas as formas de energia presentes, incluindo a química e a potencial.
Leia também: O que é entropia?
Resumo sobre entalpia
-
A entalpia é uma grandeza termodinâmica que representa a energia total de um sistema.
-
É denotada pela letra H e medida em joules (J) ou calorias (cal).
-
Envolve a energia interna do sistema e a energia necessária para manter o sistema em pressão constante.
-
A entalpia de um sistema pode mudar durante reações químicas ou transformações físicas.
-
Pode ser calculada como a diferença entre a energia absorvida pelos reagentes e a energia liberada pelos produtos.
-
Reações endotérmicas têm variação de entalpia positiva, absorvendo energia.
-
Reações exotérmicas têm variação de entalpia negativa, liberando energia.
-
Existem diferentes tipos de entalpia, como entalpia de formação, entalpia de combustão e entalpia de dissolução.
-
A entalpia é uma ferramenta importante para entender e prever o comportamento energético das reações químicas.
Videoaula sobre entalpia
O que é a entalpia?
Entalpia é uma grandeza termodinâmica relacionada à quantidade de energia trocada durante uma reação química ou uma transformação física, como mudanças de estado físico (como de sólido para líquido, ou de líquido para gasoso). Sendo assim, podemos pensar na entalpia como a quantidade total de energia de um sistema, considerando não apenas a energia interna das partículas que o compõem mas também a energia envolvida em mudanças na pressão e no volume do sistema.
Diante disso, ela é representada pela letra H e pode ser medida em joules (J) ou em calorias (cal). De modo geral, temos a seguinte forma genérica para os reagentes e produtos de uma reação:
Hr = Hentalpia dos reagentes ou “H regentes”
Hp = Hentalpia dos produtos ou “H produtos”
Quais são os tipos de entalpia?
Quanto aos tipos de entalpia, eles são classificados de acordo com o processo envolvido. Por exemplo, quando nos referimos à variação de energia que ocorre na reação de formação de uma substância composta de substâncias simples, fala-se de entalpia de formação. Por outro lado, caso a reação em questão seja uma combustão, chamamos de entalpia de combustão.
Sendo assim, vamos dar uma conferida no quadro abaixo, em que explicamos melhor sobre cada uma delas.
|
Tipo de entalpia |
Definição |
Exemplo |
|
Entalpia de Formação (ΔHf) |
Variação de entalpia na formação de um mol de uma substância com base em seus elementos constituintes no estado padrão. |
ΔHºf do metano (CH4): -74,8 kJ/mol |
|
Entalpia de Combustão (ΔHc) |
Variação de entalpia na combustão completa de um mol de uma substância em presença de oxigênio. |
ΔHºc do etanol (C2H5OH): -1367 kJ/mol |
|
Entalpia de Dissolução (ΔHdiss) |
Variação de entalpia na dissolução de um mol de uma substância em um solvente suficiente para formar uma solução infinitamente diluída. |
ΔHºdiss do cloreto de sódio (NaCl): +3,9 kJ/mol |
|
Entalpia de Neutralização (ΔHneut) |
Variação de entalpia na reação de neutralização entre um ácido e uma base, formando água e um sal. |
ΔHºneut do ácido clorídrico (HCl) com hidróxido de sódio (NaOH): -57,3 kJ/mol |
|
Entalpia de Vaporização (ΔHvap) |
Variação de entalpia na vaporização de um mol de uma substância líquida em determinada temperatura e pressão. |
ΔHºvap da água: +40,8 kJ/mol |
|
Entalpia de Fusão (ΔHfus) |
Variação de entalpia na fusão de um mol de uma substância sólida, transformando-a em líquido, em determinada temperatura e pressão. |
ΔHºfus do gelo: +6,01 kJ/mol |
Vale ressaltar que quando uma reação ocorre sob condições padrão, ela é denominada entalpia padrão. Nesse caso, as condições padrão geralmente incluem temperatura de 25 °C e pressão de 1 atm. Além disso, as condições padrão são representadas pelo símbolo ΔH°, em que grau (°) indica condições padrão.
Veja também: Processos endotérmico e exotérmicos — como ocorrem, exemplos e diferenças
A variação de entalpia
Durante uma reação química, a variação de entalpia pode ser medida como a diferença entre a quantidade de energia absorvida pelos reagentes e a quantidade de energia liberada pelos produtos. Nesse sentido, podemos equacionar isso da seguinte forma:
ΔH = H produtos – H reagentes
Ou, de forma simplificada:
ΔH = Hp – Hr
Ou, ainda:
ΔH = H final – H inicial
Logo, se a entalpia da reação for positiva (ΔH > 0), a reação é endotérmica, ou seja, absorve energia do ambiente. Por outro lado, caso ela seja negativa (ΔH < 0), a reação é exotérmica, liberando energia para o ambiente, conforme ilustrado a seguir:
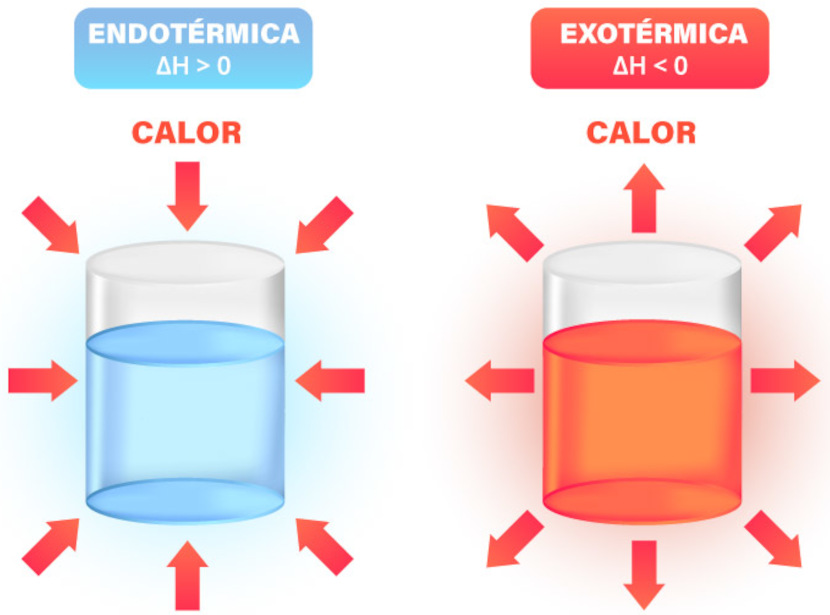
Assim, é possível prever se a reação será capaz de ocorrer espontaneamente e quais condições são necessárias para que isso aconteça. De modo análogo, podemos expressar isso em forma de gráficos que esboçam o comportamento da energia envolvida em ambos os processos:
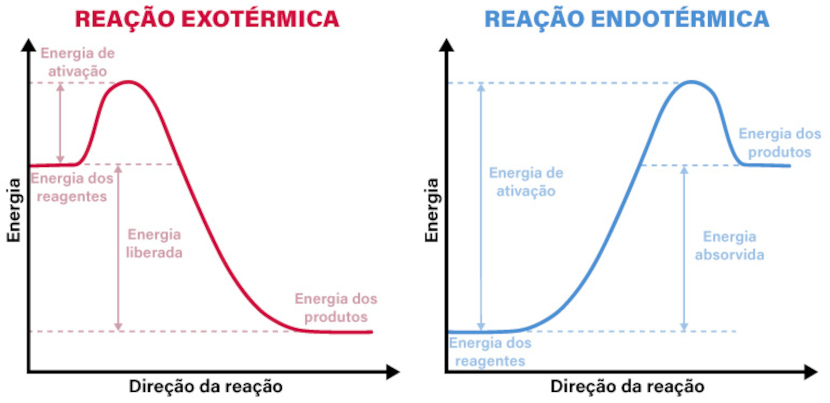
Perceba nos gráficos acima que, para uma reação exotérmica, os reagentes têm uma grande quantidade de energia armazenada, a qual é liberada à medida que a reação se processa, até alcançar o equilíbrio cuja energia interna dos produtos será menor que a inicial. Em contrapartida, na endotérmica, os reagentes estão em um estado de menor energia e precisam absorver mais para que possam reagir e formar os produtos.
Entretanto, em ambos os casos, denomina-se energia de ativação aquela necessária para que a reação aconteça. Vejamos, portanto, alguns exemplos:
Exemplo 1:
-
Entalpia de formação do metano (CH4):
C(s) + 2H2(g) → CH4(g)
ΔHºf = -74,8 kJ/mol
Nesse caso, a variação de entalpia para a formação do metano a partir de carbono e hidrogênio gasoso é -74,8 kJ/mol, o que significa que 74,8 kJ de energia são liberados para formar um mol de metano.
Exemplo 2:
-
Entalpia de combustão da glicose (C6H12O6):
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l)
ΔHºc = -2803 kJ/mol
A variação de entalpia para a combustão completa da glicose é -2803 kJ/mol, portanto, 2803 kJ de energia são liberados quando um mol de glicose é completamente queimado em excesso de oxigênio.
Exemplo 3:
-
Entalpia de dissolução do cloreto de sódio (NaCl):
NaCl(s) → Na+(aq) + Cl-(aq)
ΔHºdiss = +3,9 kJ/mol
A variação de entalpia para a dissolução do cloreto de sódio em água é +3,9 kJ/mol. Sendo assim, 3,9 kJ de energia são absorvidos para dissolver um mol de NaCl.
Exemplo 4:
-
Entalpia de vaporização da água (H2O):
H2O(l) → H2O(g)
ΔHºvap= +40,8 kJ/mol
A variação de entalpia para a vaporização da água é +40,8 kJ/mol, logo, 40,8 kJ de energia são absorvidos para vaporizar um mol de água.
Outras informações importantes sobre entalpia
Vale destacar que, neste artigo, exploramos o conceito de entalpia, sua forma de representação, bem como seus diferentes tipos. Contudo, no que tange aos cálculos, podemos fazer, ainda, o uso da lei de Hess, que será explorada melhor em outro momento.
É importante saber que a entalpia é uma função de estado. Isso significa que a entalpia de um sistema é determinada exclusivamente pelo seu estado atual, independentemente de como esse estado foi alcançado. Em outras palavras, ΔH entre dois estados depende apenas dos estados inicial e final, e não do caminho percorrido entre eles. Essa característica torna a entalpia uma ferramenta muito útil, pois facilita o estudo das reações químicas e dos processos de transferência de energia.
Saiba mais: Titulação — técnica muito usada em laboratório para determinar a quantidade de uma substância em uma solução
Exercícios resolvidos sobre entalpia
1. (Udesc) Dadas as seguintes equações:
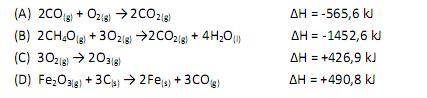
Considere as seguintes proposições em relação às equações:
I. As reações (A) e (B) são endotérmicas.
II. As reações (A) e (B) são exotérmicas.
III. As reações (C) e (D) são exotérmicas.
IV. As reações (C) e (D) são endotérmicas.
V. A reação com maior liberação de energia é a (B).
VI. A reação com maior liberação de energia é a (D).
Assinale a alternativa correta.
-
Somente as afirmativas II, III e V são verdadeiras.
-
Somente as afirmativas I, III e VI são verdadeiras.
-
Somente as afirmativas I, IV e VI são verdadeiras.
-
Somente as afirmativas II, V e VI são verdadeiras.
-
Somente as afirmativas II, IV e V são verdadeiras.
Gabarito: E
As entalpias das reações “A” e “B” são negativas, portanto, exotérmicas. Os valores das reações “C” e “D” são positivos, logo, são processos endotérmicos. Por fim, não há liberação de energia em reações endotérmicas, pelo contrário, há absorção. Portanto, o item VI está incorreto, e o item V está correto. Diante disso, nosso gabarito é: II, IV e V.
2. (UFRGS) Duas reações químicas envolvendo o gás metano, juntamente com o seu efeito térmico, são equacionadas abaixo.
C(graf) + 2 H2 (g) → CH4 (g) ΔHI
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (l) ΔHII
Considere as seguintes afirmações a respeito das reações químicas.
I - ΔHI é um exemplo de entalpia de ligação.
II - ΔHII é um exemplo de entalpia de combustão.
III - ΔHII é negativo.
Quais estão corretas?
-
Apenas I
-
Apenas II.
-
Apenas III.
-
Apenas II e III.
-
I, II e III.
Gabarito: D
Primeiro, vamos analisar cada item:
I - As substâncias simples C e H2 reagem para formar um composto. Portanto, temos uma reação de formação, logo, entalpia de formação ∆Hºf. Nesse caso, o item está errado ao afirmar que se trata de entalpia de ligação.
II - Neste item temos uma típica reação de combustão do metano (CH4) na presença de oxigênio, formando dióxido de carbono e água. Sendo assim, o item está correto, pois a entalpia será de combustão.
III - Entalpia de combustão informa a energia que é liberada durante o processo, uma vez que esse tipo de reação é exotérmica por natureza. Nesse caso o valor numérico deve ser negativo, portanto, o item está correto.
Diante disso, os itens corretos são II e III.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. A termoquímica. In: Princípios de química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 273–285.
FELTRE, R. Termoquímica. In: Química: Físico-Química. 6. ed. São Paulo: Moderna, 2004. v. 2, p. 95–121.
L. BROWN, T. et al. Termoquímica. In: Química: a ciência central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 179–197.