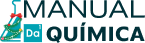Nitrogênio (N)
Descoberto por Rutherford em 1772, o nitrogênio é um dos elementos químicos mais abundantes do Universo.
Por Jhonilson Pereira Gonçalves

PUBLICIDADE
O nitrogênio é um dos elementos químicos mais abundantes do Universo e é encontrado em diversos compostos orgânicos e inorgânicos. Sua molécula é composta por dois átomos, o que o torna uma substância diatômica. Além disso, em condições normais de temperatura e pressão, é um gás inerte, ou seja, não reage facilmente com outros elementos. Isso faz com que seja utilizado em diversas aplicações, como em enchimento de pneus e em processos de resfriamento.
Leia também: Hidrogênio — o elemento químico mais abundante do Universo
Resumo sobre o nitrogênio
- O nitrogênio é um dos elementos químicos mais abundantes do Universo.
- É representado pelo símbolo N e número atômico 7.
- Constituinte principal do ar atmosférico, compreendendo cerca de 78% dele.
- Altamente estável na forma molecular diatômica (N2).
- Importante componente de moléculas biológicas, como proteínas e ácidos nucleicos, sendo, por isso, essencial à vida.
- Usado na fabricação de fertilizantes agrícolas, produtos químicos e atmosferas inertes.
- Obtido industrialmente por destilação fracionada do ar.
- Pode apresentar perigos como asfixia e queimaduras.
O que é nitrogênio?
O nitrogênio é o elemento químico identificado na Tabela Periódica com o símbolo N e número atômico 7. Além disso, caracteriza-se, nas condições normais de temperatura e pressão (CNTP), como um gás incolor, inodoro e insípido. Classificado como não metal, é encontrado predominantemente em sua forma gasosa na atmosfera terrestre, correspondendo a cerca de 78% do ar.

Apesar de sua abundância e importância, o nitrogênio é um elemento inerte, incapaz de sustentar a vida animal, razão pela qual foi originalmente denominado “azoto” por Antoine Lavoisier, derivado do grego “a” (não) e “zoe” (vida).
Quais são as propriedades do nitrogênio?
- Símbolo: N
- Número atômico: 7
- Massa atômica: 14,007 u.a.
- Série química: não metal, pertencente ao grupo 15 da Tabela Periódica.
- Configuração eletrônica: 1s² 2s² 2p³
- Eletronegatividade: 3,04 (na escala de Pauling)
- Afinidade eletrônica: -7 kJ/mol
- Eletropositividade: 3,04 (na escala de Pauling)
- Ponto de fusão: -210,1 °C
- Ponto de ebulição: -195,8 °C
- Densidade: 1,25 g/L
- Energia de ionização: 1402,3 kJ/mol
- Estado físico em temperatura ambiente: gasoso
Para que serve o nitrogênio?
O nitrogênio serve para diversas aplicações, tanto na cadeia econômica quanto na manutenção do equilíbrio ecológico.
Um exemplo disso é seu uso, na indústria química, na produção de amônia (NH3). A amônia é um componente essencial na fabricação de fertilizantes nitrogenados, como o nitrato de amônio e a ureia. Esses fertilizantes são amplamente utilizados na agricultura para fornecer nitrogênio às plantas, promovendo o crescimento saudável e aumentando a produção de alimentos.

É empregado, na indústria alimentícia, no processo de embalagem de alimentos perecíveis, como frutas, legumes, carnes e laticínios. Ele é injetado nas embalagens para criar uma atmosfera modificada de nitrogênio, que previne a oxidação, retarda a deterioração e prolonga a vida útil dos produtos.
Na sua forma líquida, o nitrogênio é amplamente utilizado na indústria metalúrgica para resfriar peças metálicas durante processos de usinagem e soldagem. O uso do nitrogênio na metalurgia ajuda evitar a oxidação dos metais durante a soldagem.
Além disso, é também utilizado na medicina para resfriar tecidos em um processo conhecido como criopreservação. Essa técnica consiste no resfriamento de células, tecidos e órgãos para transplante, conforme pode ser visto na imagem abaixo:
O nitrogênio também é empregado em laboratórios de pesquisa, hospitais e bancos de sangue para armazenar material biológico em baixas temperaturas, garantindo sua viabilidade e integridade.
Outro exemplo importante está na sua utilização na fabricação de semicondutores e dispositivos eletrônicos de alta tecnologia. Ele é empregado como gás de proteção em processos de deposição química de vapor (CVD) e epitaxia de feixe molecular (MBE), ajudando a prevenir a oxidação e a garantir a pureza dos materiais durante a produção de chips e circuitos integrados.
Principais características do nitrogênio
Quanto às características do nitrogênio, podemos citar algumas:
- Tem reatividade limitada: o nitrogênio é um elemento químico relativamente inerte em condições normais de temperatura e pressão. Isso se deve à sua forte ligação tripla (N≡N) na molécula de nitrogênio (N2), que requer uma quantidade significativa de energia para ser quebrada.
- Tem capacidade de formar vários compostos: apesar de sua baixa reatividade, o nitrogênio pode formar uma variedade de compostos químicos, incluindo a amônia (NH3), os óxidos de nitrogênio (NOx), os nitratos (NO3−) e os nitritos (NO2−), presentes no ciclo do nitrogênio. Isso ocorre devido a sua capacidade de formar múltiplas ligações covalentes, o que contribui para a sua versatilidade na formação de compostos orgânicos e inorgânicos.
- Não entra em combustão: o nitrogênio não é inflamável e não sustenta a combustão. Na verdade, ele atua como um agente de extinção de incêndios em ambientes inertes, deslocando o oxigênio e interrompendo o processo de combustão. Ao contrário de alguns outros agentes extintores, como pó químico, o nitrogênio não deixa resíduos, o que facilita a limpeza do local do incêndio.
- É essencial para a síntese de proteínas e ácidos nucleicos: outra característica importante do nitrogênio é a sua presença em diversas moléculas biológicas essenciais, como proteínas e ácidos nucleicos, sendo indispensável para a vida como a conhecemos. No caso do DNA, o nitrogênio está presente nas bases nitrogenadas, moléculas que formam a estrutura do nosso DNA. Sem o nitrogênio, o DNA não seria capaz de codificar as informações genéticas necessárias para a vida.
Veja também: Principais características da família do nitrogênio
Obtenção do nitrogênio
O nitrogênio pode ser obtido por diversos métodos, sendo os mais comuns a destilação fracionada do ar líquido e o processo de separação por membranas. Na destilação fracionada, o ar é resfriado até atingir a temperatura de liquefação do nitrogênio, separando-o dos outros componentes gasosos. Já no processo de separação por membranas, membranas seletivas de permeação são utilizadas para separar o nitrogênio dos demais gases presentes no ar.
→ Obtenção do nitrogênio por destilação fracionada do ar
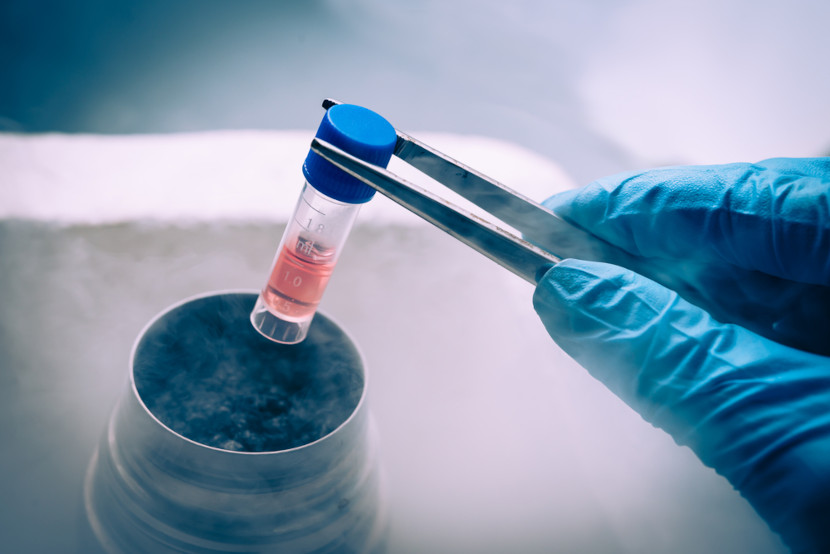
Vamos explorar mais detalhadamente o método de obtenção por destilação fracionada do ar, que é o método industrial geralmente usado. Sendo assim, veja como são divididas as etapas de obtenção do nitrogênio:
- Compressão e filtragem: o ar atmosférico é inicialmente comprimido para aumentar sua pressão e, em seguida, passa por um processo de filtragem para remover partículas sólidas e umidade que possam estar presentes.
- Resfriamento: em seguida, o ar comprimido é resfriado em temperaturas muito baixas, geralmente por meio de trocadores de calor e refrigeradores, até atingir temperaturas próximas ao ponto de condensação dos gases presentes no ar.
- Liquefação: o ar resfriado é então passado para um sistema de liquefação, no qual as diferentes temperaturas de ebulição dos gases presentes no ar são exploradas. Como o nitrogênio tem uma temperatura de ebulição mais baixa que o oxigênio, ele começa a condensar primeiro.
- Separação por destilação fracionada: a mistura líquida resultante da liquefação do ar é então introduzida em uma coluna de destilação fracionada. Nessa coluna, ocorre a separação dos diferentes componentes do ar, com os gases mais leves, como o nitrogênio, subindo até o topo da coluna e sendo retirados lá, enquanto os gases mais pesados, como o oxigênio e o argônio, permanecem na base da coluna, conforme ilustrado abaixo:
-
Coleta e purificação: o nitrogênio puro, agora separado dos outros gases, é coletado e passa por processos adicionais de purificação para remover impurezas residuais, se necessário.
-
Armazenamento e distribuição: o nitrogênio purificado é então armazenado em tanques criogênicos ou em forma gasosa pressurizada, pronto para uso em diversas aplicações industriais. Quando é armazenado como líquido criogênico em tanques, o nitrogênio é mantido em temperaturas extremamente baixas, geralmente abaixo de -196 °C.
Esse método de destilação fracionada do ar é altamente eficaz na obtenção de nitrogênio de alta pureza em grande escala, tornando-o disponível para uma variedade de aplicações.
Quais os perigos do nitrogênio?
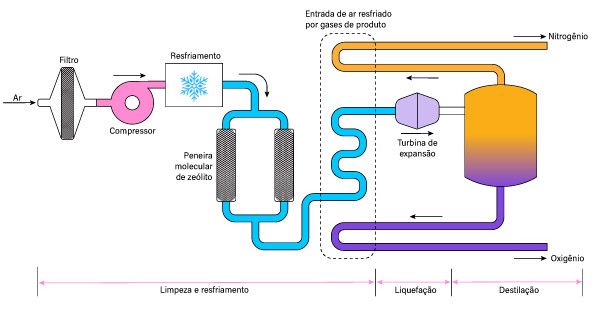
Embora seja um gás inerte em condições normais de temperatura e pressão, o nitrogênio pode representar perigo em ambientes confinados, onde sua concentração elevada pode provocar asfixia por deslocamento de oxigênio. Como o nitrogênio é mais denso que o ar, ele pode se acumular em espaços baixos, reduzindo a concentração de oxigênio disponível para respiração.
Além disso, o nitrogênio líquido pode causar queimaduras por contato direto com a pele devido à sua baixa temperatura.
É importante estar ciente desses perigos ao lidar com nitrogênio em suas várias formas e tomar as precauções adequadas para garantir a segurança pessoal e a proteção contra riscos potenciais. Isso inclui a ventilação adequada de espaços confinados, o uso de equipamentos de proteção individual (EPI) ao trabalhar com nitrogênio líquido, e seguir os procedimentos operacionais seguros ao lidar com o nitrogênio em ambientes industriais ou laboratoriais.
História do nitrogênio

O nitrogênio foi descoberto no final do século XVIII por Daniel Rutherford, um químico escocês, em 1772. Ele isolou o nitrogênio pela primeira vez ao remover oxigênio e dióxido de carbono do ar atmosférico, percebendo que um gás inerte permanecia. Rutherford chamou esse gás de “ar fixo”, mas ele logo foi renomeado como nitrogênio por Antoine Lavoisier, um químico francês, em 1777.
Após a descoberta inicial, muitos cientistas, incluindo Joseph Priestley e Carl Wilhelm Scheele, contribuíram para a compreensão do nitrogênio e suas propriedades ao realizarem, de forma independente, estudos similares ao de Lavoisier, em que ambos trabalharam na descoberta do oxigênio e, consequentemente, confirmaram a existência do nitrogênio. Contudo, foi somente no início do século XIX que John Dalton propôs uma teoria atômica do nitrogênio, descrevendo sua estrutura e comportamento em termos de átomos indivisíveis.
É importante destacar que, inicialmente, o nitrogênio não tinha muitas aplicações diretas, mas, com o tempo, tornou-se crucial na produção de fertilizantes. Em 1909, Fritz Haber desenvolveu um método para sintetizar amônia com base em nitrogênio e hidrogênio, um processo que se tornou essencial para a fabricação de fertilizantes nitrogenados em larga escala.
Já durante o século XX, o nitrogênio se tornou fundamental em uma variedade de campos, principalmente durante as duas Guerras Mundiais, em que ele foi crucial para a produção de explosivos, especialmente a nitroglicerina, a trinitrotolueno (TNT) e a nitrocelulose. Durante as Guerras Mundiais, esses explosivos foram amplamente utilizados em armamentos militares, como bombas, granadas e munições.
Além disso, o nitrogênio foi empregado na produção de fertilizantes para a agricultura, o que era importante para garantir o fornecimento de alimentos durante períodos de guerra, quando a produção agrícola era essencial para sustentar as populações em conflito.
Hoje, sabe-se que, além de fazer parte de processos biogeoquímicos e de ser essencial para vida, atualmente o nitrogênio é amplamente utilizado em uma variedade de indústrias, como a química, a alimentícia, a metalúrgica, a medicina, entre outras.
Curiosidades sobre o nitrogênio
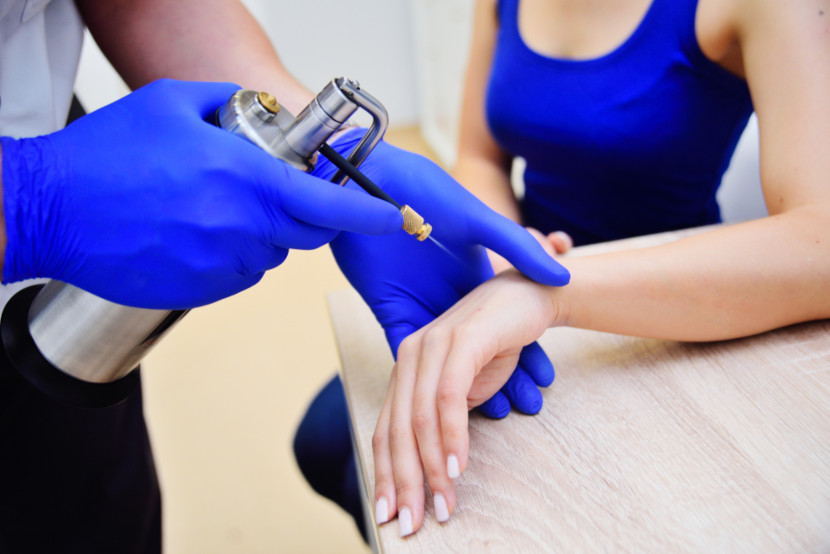
- O nitrogênio líquido pode ser utilizado em tratamentos dermatológicos, como a crioterapia, para congelar e destruir tecidos anormais, como verrugas, lesões pré-cancerígenas ou pequenos tumores.
-
Apesar de sua abundância na atmosfera, o nitrogênio não pode ser absorvido diretamente pelas plantas, pois, para tanto, ele precisa ser fixado por meio de bactérias ou processos industriais.
-
Embora o nitrogênio tenha muitas aplicações benéficas, o excesso de uso de fertilizantes nitrogenados na agricultura pode contribuir para problemas ambientais, como a eutrofização, que ocorre devido à rápida proliferação de algas e cianobactérias no ambiente aquático decorrente do excesso de nutrientes como o nitrogênio.
Fontes
CARVALHO, N. L.; ZABOT, V. NITROGÊNIO: NUTRIENTE OU POLUENTE? Revista Eletrônica em Gestão, Educação e Tecnologia Ambiental, v. 6, n. 6, 13 mar. 2012.
DRISCOLL, C. et al. Nitrogen pollution: Sources and consequences in the U.S. Northeast. Environment, v. 45, n. 7, p. 8–22, 2003.
FERREIRA, E. CINÉTICA QUÍMICA E FUNDAMENTOS DOS PROCESSOS DE NITRIFICAÇÃO E DENITRIFICAÇÃO BIOLÓGICA. XXVII Congresso Interamericano de Engenharia Sanitária e Ambiental I-121, p. 26, 2021.
FOLLETT, R. F.; HATFIELD, J. L. Nitrogen in the environment: sources, problems, and management. TheScientificWorldJournal, 2001.
MATASSA, S. et al. How can we possibly resolve the planet’s nitrogen dilemma? Microbial Biotechnology, 2023.
NITROGEN Fixation in Agriculture, Forestry, Ecology, and the Environment. [s.l: s.n.].
PEIXOTO, E. M. A. Nitrogênio. São Paulo: [s.n.].
VIEIRA, R. F. Ciclo do Nitrogênio. [s.l: s.n.]. v. 1