Amônia (NH3)
A amônia (NH3) é um gás incolor de odor forte, produzido principalmente pelo processo Haber-Bosch, que possui grande importância para a fabricação de fertilizantes.
Por Ana Luiza Lorenzen Lima

PUBLICIDADE
A amônia (NH3) é um gás incolor de odor forte e característico e de caráter básico. Possui ação corrosiva, sendo altamente irritante à pele e às mucosas. A exposição a altos níveis de amônia pode causar sérias complicações às vias respiratórias.
A amônia é naturalmente gerada pela decomposição da matéria orgânica. Em escala industrial, é produzida principalmente pelo processo Haber-Bosch, sendo um dos reagentes químicos mais utilizados do mundo. Cerca de 80% da produção de amônia é direcionada para a fabricação de fertilizantes, empregados na produção de alimentos.
Leia também: Hidróxido de sódio — um sólido muito corrosivo e tóxico usado principalmente na produção de sabão
Resumo sobre amônia
• A amônia (NH3) é um gás em temperatura ambiente, com cheiro forte e característico.
• Possui caráter básico e corrosivo.
• É agressivo a pele e mucosas, podendo causar sérios danos, dependendo da concentração da exposição.
• A decomposição de matéria orgânica é uma fonte natural de amônia.
• A amônia está presente em efluentes industriais e domésticos.
• Industrialmente, ela é gerada pelo processo Haber-Bosch.
• No processo Haber-Bosch, os gases N2 e H2 são reagidos em alta temperatura e pressão, para formar o NH3.
• A maior parte da amônia é utilizada na produção de fertilizantes.
• Os primeiros registros de uso de amônia remontam à Antiguidade Clássica.
Propriedades da amônia
• Fórmula molecular: NH3
• Massa molecular: 17,03 g/mol
• Estado físico: gás (incolor e de forte odor)
• Densidade: 0,6942 g/L
• Solubilidade em água: 541 g/L (20 °C)
• Temperatura de fusão: -77,7 °C
• Temperatura de ebulição: -33,3 °C
• Acidez (pKa): 9,25
• Momento de dipolo: 1,42 D
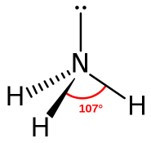
• Ângulo de ligação: 107,8°
Características da amônia
Também conhecida como amoníaco, a amônia é um composto inorgânico que se apresenta sob a forma de gás incolor de odor pungente, solúvel em água e em alguns compostos orgânicos, como álcoois.
Em baixa concentração, a amônia se parece com o odor de urina, uma vez que esta é rica em ureia, um derivado da amônia. Na presença de umidade, a amônia se torna corrosiva, sendo perigosa em casos de inalação.
Em contato com a água, a amônia forma o íon amônio (NH4+), originando uma solução de caráter básico em razão da geração de íons hidroxila (OH-).
\({NH}_3\left(g\right)+\ H_2O\ \left(l\right)\longrightarrow\ {NH}_4^+\left(aq\right)+\ {OH}^-(aq)\)
A amônia possui fórmula química NH3, sendo formada por um átomo de nitrogênio e três átomos de hidrogênio, arranjados em uma estrutura com geometria piramidal trigonal, com ângulo de ligação de 107,8°. O átomo de nitrogênio conta com um par de elétrons isolados, e é por isso que a amônia é uma base, devido a sua capacidade de abstrair prótons.
A amônia ocorre no meio ambiente por meio de fontes naturais e artificiais. É gerada pela decomposição de matéria orgânica e tem sua presença aumentada em regiões de criação de bovinos, frangos e suínos. Fontes não agrícolas são o lodo de esgoto, a atividade industrial e os veículos que possuam conversores catalíticos.
A amônia e seus derivados, como a ureia, possuem ampla aplicação na agricultura. Em razão da elevada biodegradabilidade, são facilmente processados pelas plantas, atuando como fonte de nitrogênio para vegetais e solos. A amônia é um componente comum em produtos de limpeza e é usada como gás refrigerador.
Obtenção da amônia
A amônia é um dos reagentes químicos mais consumidos do mundo. Estima-se que, em 2021, foram produzidas cerca de 235 milhões de toneladas de amônia, sendo que, aproximadamente, 80% desse total foram destinados à indústria de fertilizantes agrícolas, empregados na geração de alimentos.
Existem diferentes procedimentos para a síntese de amônia. Em nível industrial, o processo Haber-Bosch é o procedimento de obtenção de amônia mais utilizado.
Nesse processo, o nitrogênio atmosférico (N2) é convertido em amônia pela reação com o gás hidrogênio (H2), utilizando um catalisador metálico sob alta pressão (acima de 100 bar) e em temperatura entre 400-500 °C. A reação química e as condições do processo estão descritas abaixo:
\(N_2\left(g\right)+3\ H_2\left(g\right)\rightleftarrows{2\ NH}_3(g)\)
• +100 bar
• 400-500 °C
• Catalisador: partículas de ferro
Nesse procedimento, os reagentes e produtos ocupam o mesmo vaso reacional e a separação da amônia se dá pelo seu maior ponto de ebulição, sendo possível submetê-la à condensação e obter amônia de forma isolada, deixando os demais gases que ainda não reagiram para a continuidade do processo.
Tipicamente, essa reação possui rendimento de apenas 15%, no entanto, os gases não reagidos podem ser reaproveitados, e sua eficiência real pode alcançar 97%. O catalisador geralmente são partículas de ferro finamente divididas cuja função é reduzir a energia de ativação da reação, tornando-a mais rápida.
O gás hidrogênio usado no processo de Haber-Bosch é obtido por meio da reforma catalítica do gás natural ou de outros combustíveis fósseis, como o carvão. Há outras fontes de gás hidrogênio, ambientalmente mais amigáveis, como biomassa e eletrólise da água, mas que ainda não são competitivas industrialmente.

Precauções com a amônia
A amônia pode ser tóxica aos seres vivos, dependendo da concentração da exposição. Em níveis de 30 mg/L, seu odor característico já pode ser detectado. A partir de 50 mg/L, manifestam-se irritações nas mucosas de nariz e olhos. Acima de 1000 mg/L, pode haver disfunção pulmonar, e, em níveis superiores a 1500 mg/L, a exposição à amônia pode ser fatal.
No ambiente aquático, a amônia é um dos analitos monitorados para a determinação de qualidade das águas. Esse composto é tóxico à vida de algumas espécies de peixes, mesmo em baixa concentração. Além disso, a amônia consome oxigênio dissolvido em água por meio de sua oxidação, prejudicando a sobrevivência de animais e plantas. A resolução Conama n° 357 determina os níveis aceitáveis desse composto em águas.
→ Perigos da amônia ao organismo

Os efeitos da amônia sobre o organismo geralmente são imediatos. A exposição às baixas concentrações de amônia pode causar irritação nos olhos, nariz e garganta. Em níveis mais elevados, a amônia pode causar queimaduras e inchaço nas vias aéreas e danos aos pulmões, podendo levar à morte.
A ingestão de soluções de amônia pode causar queimaduras em todo o trato digestivo. Em casos mais graves, o sistema respiratório, o estômago e o coração podem ser atingidos. A presença dessa substância na corrente sanguínea afeta a função da hemoglobina em transportar oxigênio.
Soluções concentradas de amônia, em contato com a pele, podem causar queimaduras graves. Gases e vapores de amônia também podem causar danos corrosivos à pele, a depender da concentração. Pela ação corrosiva, o contato de amônia com os olhos pode causar danos muito severos aos olhos e, em alguns casos, perda da visão.
História da amônia
Os primeiros registros da amônia remetem à Antiguidade Clássica, em torno de VIII a.C., quando a urina fermentada por bactéria originava uma solução (amônia) empregada no processo de curtimento de peles e tingimento de tecidos. Ao longo dos séculos, ela continuou sendo usada em aplicações têxteis.
No século XV, Basilius Valentinus obteve amônia pela reação entre sal amoníaco e álcalis. A amônia no estado gasoso foi obtida por Joseph Black, em 1756, por meio da reação entre cloreto de amônio e óxido de magnésio, e apenas em 1785 sua composição foi comprovada, por Claude Louis Berthollet.
O ponto mais relevante na história da amônia foi o desenvolvimento do processo Haber-Bosch. Fritz Haber publicou um artigo apresentando a ideia teórica de produção da amônia em 1909. Em 1910, a empresa BASF patenteou a ideia de Haber, e seu engenheiro, Carl Bosch, foi incumbindo de implementar a ideia em grande escala.
Haber e Bosch foram agraciados com o Prêmio Nobel em 1918 e 1931 respectivamente, em razão de suas descobertas, tamanha a importância delas para o mundo moderno.
![Fritz Haber (esquerda) e Carl Bosch (direita), inventores do processo de produção de amônia em grande escala. [1]](https://static.manualdaquimica.com/2023/01/inventores-producao-amonia.jpg)
Contudo, uma das primeiras aplicações das toneladas de amônia produzidas pelo processo Haber-Bosch foi a produção em massa de explosivos usados nos conflitos durante a Segunda Guerra Mundial.
Por outro lado, a possibilidade de produção de amônia em escala gigantesca possibilita a fabricação de grande quantidade de fertilizantes, essenciais para o desenvolvimento da humanidade, pois são diretamente responsáveis pela produção de alimentos para o mundo.
Crédito de imagem
[1] Wikimedia Commons (reprodução)