Classificação dos óxidos
A classificação dos óxidos ocorre de acordo com os elementos que os formam e segundo os compostos que dão origem em suas reações à água, ácidos e bases.
Por Jennifer Rocha Vargas Fogaça
PUBLICIDADE
Os óxidos são compostos inorgânicos binários, isto é, formados por dois elementos, sendo que o mais eletronegativo deles é o oxigênio.
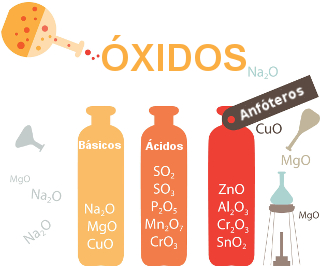
Existem vários tipos de óxidos que podem ser classificados segundo a sua composição e de acordo com o seu comportamento frente a outros compostos como a água, os ácidos e as bases. Veja a classificação dos óxidos:
* Óxidos ácidos: São aqueles óxidos que reagem com água e formam um ácido, ou que reagem com uma base e formam um sal e água, ou seja, agem como se fossem um ácido nessas condições.
ÓXIDO + ÁGUA → ÁCIDO
SO3 (g) + H2O(l) → H2SO4 (aq)
trióxido de água ácido
enxofre sulfúrico
CO2 (g) + H2O(l) → H2CO3(aq)
dióxido de água ácido
carbono carbônico
ÓXIDO + BASE → SAL + ÁGUA
SO3 (g) + 2 NaOH(aq) → 1 Na2SO4 (aq) + 1 H2O
trióxido de hidróxido sulfato de água
enxofre de sódio sódio
CrO3(g) + 2 NaOH(aq) → 1 Na2CrO4 (aq) + 1 H2O
trióxido de hidróxido sulfato de água
cromo de sódio cromo
Um exemplo que foi mostrado acima é o dióxido de carbono (CO2) que está presente na atmosfera, na fotossíntese, na respiração etc. No estado sólido, ele é o gelo-seco e o gás usado em refrigerantes e águas gaseificadas.

O gás dióxido de carbono é um óxido ácido que é utilizado em refrigerantes
Os óxidos ácidos são compostos formados por ametais e têm caráter covalente. Além dos mostrados acima, outros exemplos de óxidos ácidos são: SO2, P2O5, Cl2O6, NO2, N2O4, N2O5, entre outros.
Eles são também chamados de anidridos de ácidos, pois a palavra anhydros significa “sem água”, e os óxidos ácidos podem ser considerados “ácidos sem água”. Conforme é mostrado a seguir, eles podem ser formados pela eliminação total dos hidrogênios na forma de água de um ácido oxigenado:
ÁCIDO → ÁGUA + ÓXIDO ÁCIDO
H2SO4 (aq) → H2O(l) + SO3(g)
* Óxidos básicos: São aqueles óxidos que reagem com água e formam uma base, ou reagem com um ácido e formam um sal e água.
ÓXIDO ÁGUA BASE
1 Na2O(g) + 1 H2O(l) → 2 NaOH(aq)
óxido de água hidróxido de
sódio sódio
ÓXIDO ÁCIDO SAL ÁGUA
1 Na2O(g) + 1 H2SO4 (aq) → 1 Na2SO4 (aq) +1 H2O
óxido de ácido sulfato de água
sódio sulfúrico sódio
Os óxidos básicos são formados por metais e possuem caráter iônico, porque esses metais são elementos altamente eletropositivos, apresentando normalmente a “carga” igual a +1 ou +2, tais como o Na2O, K2O, CaO, MgO.
O óxido de potássio (K2O) presente nas cinzas da madeira e do cigarro é um exemplo de óxido básico. Antigamente, o sabão de cinzas era produzido por uma reação entre gorduras e as cinzas dos vegetais, porque, graças a esse caráter básico, o K2O substituía a base NaOH (hidróxido de sódio) em lugares em que ela não era encontrada.

As cinzas do cigarro contêm óxido de potássio, um óxido básico
* Óxidos anfóteros: São aqueles óxidos que ora se comportam como óxidos ácidos, ora como óxidos básicos.
Um exemplo é o óxido de zinco, mais conhecido como alvaiade — um pó branco usado na pintura de rostos dos palhaços e como protetor solar. Observe abaixo que, na presença de uma base forte, ele reage e forma um sal e água, como fazem os óxidos ácidos:
ÓXIDO + BASE FORTE → SAL + ÁGUA
ZnO(s) + 2NaOH(aq) → Na2ZnO2(aq) + H2O(l)
Por outro lado, se esse óxido for colocado em contato com um ácido forte, ele reagirá como um óxido básico, pois forma como produtos um sal e água:
ÓXIDO + ÁCIDO FORTE → SAL + ÁGUA
ZnO(s) + H2SO4(aq) → ZnSO4(aq) + H2O(l)

O óxido de zinco é o alvaiade, um óxido anfótero usado em pinturas dos rostos dos palhaços
Outros exemplos de óxidos anfóteros são formados por metais (Al2O3, SnO, SnO2, PbO, PbO2) e por ametais (As2O3, As2O5, Sb2O3, Sb2O3).
* Óxidos duplos (salinos ou mistos): São aqueles óxidos que se comportam como se fossem formados por dois óxidos do mesmo elemento químico.
Por exemplo, o tetróxido de chumbo (Pb3O4), mais conhecido como zarcão, muito usado em revestimentos de peças de ferro para protegê-las contra a formação de ferrugem, é um óxido duplo, pois se comporta como se fosse formado pelos óxidos PbO2 e PbO.

O zarcão é o tetróxido de chumbo, um óxido duplo usado na proteção do ferro
Outro exemplo é a magnetita, ou tetróxido de ferro (Fe3O4), que é formada pelos óxidos de ferro FeO e Fe2O3.
Veja abaixo como ela reage como se fosse uma mistura desses dois óxidos:
FeO + H2SO4 → FeSO4 + H2O +
Fe2O3 + 3 H2SO4 → Fe2(SO4)3 + 3 H2O
__________________________________________
Fe3O4 + 4 H2SO4 → FeSO4 + Fe2(SO4)3 +4 H2O
* Óxidos neutros (indiferentes ou inertes): São aqueles óxidos que não reagem com ácidos, bases e nem com água. Eles são formados por ametais e possuem caráter covalente.
Um exemplo de óxido neutro é o óxido nitroso ou monóxido de dinitrogênio (N2O), que foi muito usado como anestésico. Além disso, ele também ficou conhecido como gás hilariante, em virtude da euforia que causa na pessoa que o inala.

Mulher inalando óxido nitroso, um óxido neutro
Outros exemplos de óxidos neutros são o monóxido de carbono (CO) e o monóxido de mononitrogênio (NO).
* Peróxidos: São aqueles óxidos que possuem em sua estrutura o grupo (O2)2-.
O peróxido mais conhecido é o peróxido de hidrogênio que, na forma de solução aquosa, é conhecido como água oxigenada. Sua fórmula é H2O2.

A água oxigenada é o peróxido de hidrogênio em solução aquosa
Os peróxidos reagem com água ou com ácidos diluídos e produzem a água oxigenada. Veja:
Peróxido + água → base + água oxigenada
K2O2 + 2 H2O → 2 KOH + H2O2
Peróxido + ácido → sal + água oxigenada
K2O2 + 2 HCl → 2 KCl + H2O2
Outros exemplos de peróxidos são formados por metais alcalinos (Li2O2, Na2O2, K2O2) e por metais alcalinoterrosos (MgO2, CaO2, BaO2).
Aproveite para conferir nossas videoaulas relacionadas ao assunto: