Reações com óxidos
Reações com óxidos são processos químicos nos quais os óxidos reagem entre si e com outras substâncias (ácidos, bases e água).
Por Diogo Lopes Dias

PUBLICIDADE
Reações com óxidos são fenômenos químicos em que pelo menos um dos reagentes é um óxido. Os produtos formados nessas reações dependem do tipo de óxido e do outro reagente. Assim, é fundamental, inicialmente, conhecer as características dos óxidos e a natureza (ácida, básica ou neutra) do outro reagente.
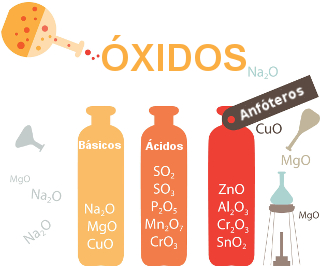
a) Óxidos ácidos:
São óxidos de caráter covalente formados pela interação de ametais com o oxigênio. O crômio VI, com exceção, é um metal capaz de formar um óxido covalente, cuja fórmula é CrO2.
b) Óxidos básicos
São óxidos iônicos formados por metais que não formam óxidos anfóteros.
c) Óxidos anfóteros
São óxidos iônicos formados exclusivamente pelos elementos alumínio, prata, zinco, berílio, crômio III, chumbo, estanho e antimônio.
e) Óxido misto, duplo ou salino
É o óxido iônico formado por algum metal que apresenta a capacidade de formar dois cátions diferentes. Todo óxido misto apresenta uma mesma fórmula química: X3O4.
→ Reações com óxidos ácidos
a) Reação de um óxido ácido com água
Quando um óxido ácido reage com a água (H2O), ele forma um ácido inorgânico. Veja a reação do dióxido de enxofre com a água a seguir:
SO2 + H2O → H2SO3
Na equação acima, ocorre a formação do ácido sulfuroso.
Obs.: Quando anidridos ácidos reagem com água, temos a formação de dois ácidos diferentes. Veja a reação do hexóxido de dicloro com água:
Cl2O6 + H2O → HClO3 + HClO4
O hexóxido de dicloro é também chamado de anidrido clórico perclórico. Origina o ácido clórico e o ácido perclórico quando reage com a água.
b) Reação de um óxido ácido com uma base inorgânica
Quando um óxido ácido reage com uma base inorgânica, temos a formação de um sal inorgânico e água. Veja a reação entre o dióxido de enxofre e o hidróxido de sódio:
SO2 + 2 NaOH → Na2SO3 + H2O
Nessa reação, temos a formação de água e um sal, que apresenta o metal da base e o ânion SO3-2 (formado quando o óxido em questão reage com a água).
c) Reação de um óxido ácido com um óxido básico
Quando um óxido ácido reage com um óxido básico, temos a formação de um sal inorgânico. Veja a reação entre o dióxido de enxofre e o óxido de sódio:
SO2 + Na2 O → Na2SO3
O sal formado nessa reação apresenta o metal do óxido básico e o ânion SO3-2 (formado quando o óxido ácido em questão reage com a água).
→ Reações com óxidos básicos
a) Reação de um óxido básico com água
Quando um óxido básico reage com H2O, ele forma uma base inorgânica. Veja a reação do óxido de sódio com a água:
Na2O + H2O → 2 NaOH
Na equação acima, temos a formação do hidróxido de sódio.
b) Reação de um óxido básico com um ácido inorgânico
Quando um óxido básico reage com um ácido inorgânico, temos a formação de um sal inorgânico e água. Veja a reação entre o óxido de sódio e o ácido bromídrico:
Na2O + 2 HBr → 2 NaBr + H2O
O sal formado apresenta o metal da base (Na+1) e o ânion Br-, que é formado quando o óxido em questão reage com a água.
→ Reações com óxidos anfóteros
a) Reação de um óxido anfótero com um ácido inorgânico
Quando um óxido anfótero reage com um ácido inorgânico, forma um sal inorgânico (constituído pelo metal do óxido e pelo ânion do ácido) e água. Veja a reação entre o óxido de alumínio e o ácido clorídrico:
1 Al2O3 + 6 HCl → 2 AlCl3 + 3 H2O
O sal formado apresenta o metal do óxido anfótero (Al+3) e o ânion Cl- do ácido.
b) Reação de um óxido anfótero com uma base inorgânica
Quando um óxido anfótero reage com uma base inorgânica, há a formação de um sal inorgânico (formado pelo metal da base e pelo ânion formado a partir do metal do óxido) e água. Veja a reação entre o óxido de alumínio e o hidróxido de potássio:
1 Al2O3 + 2 KOH → 2 KAlO2 + H2O
O sal formado apresenta o metal da base (K+) e o ânion AlO2-.
→ Reações com óxidos mistos, duplos ou salinos
a) Reação de um óxido misto com água
Quando um óxido misto reage com água, temos a formação de duas bases inorgânicas, cada uma contendo o metal com uma carga diferente. Veja a reação do óxido duplo de estanho com água:
1 Sn3O4 + 4H2O → 1 Sn(OH)2 + 2 Sn(OH)4
Como o óxido misto apresenta o metal estanho e esse elemento forma os cátions bivalente (Sn+2) e tetravalente (Sn+4), logo, as bases formadas são Sn(OH)2 e Sn(OH)4.
b) Reação de um óxido misto com ácido inorgânico
Quando um óxido misto reage com um ácido inorgânico, temos a formação de dois sais inorgânicos e água. Em cada um dos sais, o ânion do ácido interage com um cátion de carga diferente do metal. Veja a reação do óxido duplo de estanho com o ácido fosfórico:
2 Sn3O4 + 6 H3PO4 → 1 Sn3(PO4)2 + 1 Sn3(PO4 )4+ 9 H2O
Essa reação forma dois sais. Cada um deles apresenta o ânion PO4-3 do ácido interagindo com um dos dois (Sn+2 e Sn+4) cátions formados pelo metal do óxido misto.
c) Reação de um óxido misto com uma base inorgânica
Quando um óxido misto reage com uma base inorgânica, temos a formação de dois sais inorgânicos e água. Cada um dos sais contém o cátions provenientes da base e um dos ânions formados pelo metal do óxido, já que esse metal apresenta dois cátions de carga diferente. Veja a reação do óxido duplo de estanho com o hidróxido de sódio:
1 Sn3O4 + 6 NaOH → 2 Na2SnO2+ 1 Na2SnO3 + 3 H2O
Cada um dos sais formados na reação apresenta o cátion (Na+) da base interagindo com um dos dois ânions (SnO2-2 e SnO3-2) formados pelo metal do óxido misto.
Por Me. Diogo Lopes Dias