Ionização dos ácidos
A ionização dos ácidos é um fenômeno de produção de íons que ocorre quando essas substâncias se dissolvem em água e produzem muitos, moderadamente ou poucos íons.
Por Diogo Lopes Dias

PUBLICIDADE
A ionização dos ácidos é um fenômeno químico que foi estudado e desvendado pelo químico sueco Arrhenius. Nesse processo, há a produção de um cátion e de um ânion sempre que um ácido entra em contato com a água.

Arrhenius foi o cientista que propôs a ionização dos ácidos*
A presença dos cátions e ânions, produzidos pela ionização dos ácidos, possibilita que a água seja um meio condutor de eletricidade. Dessa forma, quanto mais íons o ácido produzir, mais eletricidade a água poderá conduzir.
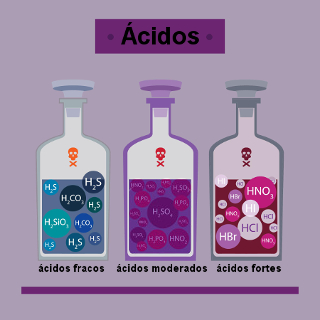
A ionização dos ácidos é conhecida também pela expressão força dos ácidos, já que muitos autores atribuem esse termo à capacidade dessas substâncias de produzir íons. Essa capacidade pode ser alta, moderada ou mínima, como veremos a seguir.
Equações de ionização dos ácidos
Para representar a ionização dos ácidos, podemos utilizar equações químicas, as quais obedecem ao seguinte padrão:
Reagentes → Produtos
No caso da ionização dos ácidos, os reagentes são sempre o ácido e a água, e os produtos são o cátion hidrônio (H+) e um ânion qualquer (X-), como no modelo abaixo:
HX + H2O → H+ + X-
Observe que o cátion hidrônio apresenta uma segunda forma de representação, o H3O+:
HX + H2O → H3O+ + X-
1º Exemplo: equação de ionização do ácido permangânico (HMnO4)
HMnO4 + H2O → 1 H+ + MnO4-
Note que a carga do ânion está relacionada à quantidade de cátions hidrônio produzidos.
2º Exemplo: equação de ionização do ácido sulfídrico (H2S)
H2S + 2 H2O → 2 H3O+ + S-2
Como a quantidade de hidrogênios ionizáveis no H2S é igual a 2, são necessários, nessa reação, 2 mol de água, produzindo 2 mol de hidrônio e um ânion de carga -2.
O grau de ionização é a medida matemática da ionização dos ácidos, ou seja, é um dado numérico que, quando calculado, indica em termos de porcentagem a quantidade de íons produzidos quando o ácido está dissolvido em água.
Para determinar o grau de ionização dos ácidos, basta utilizar a seguinte expressão:
α = número de partículas ionizadas
número de partículas adicionadas
Observação: Para obter esse resultado do α em porcentagem, basta multiplicá-lo por 100.
A partir do resultado encontrado no cálculo do α, podemos determinar se um ácido ioniza muito, moderadamente ou pouco, ao estar dissolvido em água, utilizando o seguinte critério:
-
Para α maior ou igual a 50% = ácido forte ou que ioniza muito;
-
Para α menor que 50% e maior que 5% = ácido moderado ou que ioniza moderadamente;
-
Para α menor ou igual a 5% = ácido fraco ou que ioniza pouco.
Por exemplo, ao adicionar um total de 90 moléculas de um ácido HX em água, e destes apenas 40 sofrerem ionização, o grau de ionização será:
α = número de partículas ionizadas
número de partículas adicionadas
α = 40
90
α = 0,444 (aproximadamente)
Se multiplicarmos o resultado por 100, teremos uma porcentagem de 44,4 %, o que indica que esse ácido ioniza de forma moderada em água.
Determinação da ionização dos ácidos por meio de suas fórmulas
Podemos afirmar se um ácido ioniza pouco, muito ou moderadamente, tendo como base sua fórmula molecular. Porém, para isso, temos os seguintes critérios:
a) Para hidrácidos (ácidos que não apresentam oxigênio em sua composição):
-
Forte (que ioniza muito): apenas os ácidos HCl, HBr e HI;
-
Moderado (que ioniza moderadamente): apenas HF;
-
Fraco (que ioniza pouco): qualquer outro hidrácido.
b) Para oxiácidos (ácidos que apresentam oxigênio em sua composição):
Para classificar esses ácidos, devemos subtrair o número de oxigênios pelo número de hidrogênios ionizáveis presentes em sua estrutura. Assim, esse tipo de substância classifica-se em:
-
Forte: quando a subtração resultar em um número maior ou igual a 2;
-
Moderado: quando a subtração resultar em 1;
-
Fraco: quando a subtração resultar em um número igual a 0.
Atenção: O ácido H2CO3 é fraco, mesmo apresentando uma subtração igual a 1.
*Créditos da imagem: Boris15/shutterstock.com