Nomenclatura dos ácidos
A nomenclatura dos ácidos é uma forma sistemática de nomear ácidos clássicos da Química inorgânica.
Por Stéfano Araújo Novais

PUBLICIDADE
A nomenclatura dos ácidos é uma forma sistemática de nomear ácidos clássicos da Química inorgânica. Tais substâncias começaram a ser utilizadas muito antes das teorias ácido-base modernas. Assim sendo, a União Internacional de Química Pura e Aplicada (Iupac) permite a manutenção de seus nomes e suas regras para construção.
A nomenclatura dos ácidos é utilizada levando-se em conta a presença (ou não) de oxigênio na molécula, bem como sua quantidade, assim como o número de oxidação do elemento central. Os hidrácidos, que não têm oxigênio, têm sufixo -ídrico, enquanto os oxiácidos podem ter o sufixo -oso ou -ico.
Leia também: Como é feita a nomenclatura dos ácidos carboxílicos?
Resumo sobre a nomenclatura dos ácidos
- A nomenclatura dos ácidos é uma forma sistemática de nomear ácidos clássicos da Química inorgânica.
- Tais ácidos foram descobertos muito antes das teorias modernas de ácido-base, quando o conceito de ácido ainda remetia a uma classe de compostos.
- Para se fazer a nomenclatura, deve-se dividir os ácidos em hidrácidos e oxiácidos.
- Os hidrácidos, que não têm oxigênio em sua estrutura, recebem o sufixo -ídrico.
- Os oxiácidos, que têm oxigênio em sua estrutura, recebem o sufixo -oso ou -ico, a depender da quantidade de oxigênio presente na estrutura ou número de oxidação do elemento central.
Videoaula sobre nomenclatura dos ácidos
Como é feita a nomenclatura dos ácidos?
A nomenclatura dos ácidos é uma forma sistemática de nomear ácidos clássicos da Química inorgânica. Os ácidos clássicos da Química inorgânica têm regras específicas de nomenclatura, de acordo com a classe em que se encontram. Essa subdivisão em classes se inicia na segunda metade do século XVIII e permanece até hoje, embora o conceito de ácido já tenha sido alterado.
Àquela época, acreditava-se que o oxigênio era um elemento essencial para os ácidos (não à toa o termo oxigênio significa “formador de ácido”), sendo Antoine Lavoisier o criador da tese. Posteriormente, deu-se ao hidrogênio o posto de elemento essencial para os ácidos, com base nos trabalhos de Humphry Davy, Pierre Louis Dulong e, um pouco depois, Justus von Liebig. Assim, surgiram duas classes de ácidos: os hidrácidos, os quais não têm oxigênio, e os oxiácidos, os quais têm.
As regras de nomenclatura para tais compostos datam também dessa época e são mantidas pela União Internacional de Química Pura e Aplicada (Iupac). Por tais regras, esses compostos devem iniciar sua nomenclatura oficial com o termo ácido, sucedido pelo nome do elemento com um sufixo específico, conforme a seguir:
- -ídrico para os hidrácidos;
- -oso para os oxiácidos com menor teor de oxigênio (ou menor número de oxidação para o elemento central);
- -ico para os oxiácidos com maior teor de oxigênio (ou maior número de oxidação para o elemento central).
Importante: Essas regras aplicam-se apenas aos ácidos clássicos da Química inorgânica. Isso porque, com o avanço dos conceitos de ácido (hoje se entende mais ácido como um comportamento químico desenvolvido em uma reação, não como uma substância pertencente a uma classe), novas substâncias foram sendo consideradas, porém não receberam o termo ácido em sua nomenclatura. A Iupac até tem uma nomenclatura sistemática para compostos inorgânicos, que não distingue substâncias em ácidas ou não (tirando, assim, o peso de classe de composto), mas, ainda assim, reconhece que os ácidos clássicos da Química inorgânica são tão comuns e utilizados que a nomenclatura demonstrada a seguir ainda é aceita tranquilamente.
Nomenclatura dos hidrácidos
Os hidrácidos são espécies ácidas que têm o hidrogênio, mas não a presença do elemento oxigênio em sua constituição. Esses compostos devem iniciar sua nomenclatura oficial com o termo ácido sucedido pelo nome do elemento com o sufixo -ídrico. São exemplos:
- HCl: ácido clorídrico
- HF: ácido fluorídrico
- HI: ácido iodídrico
- HBr: ácido bromídrico
- H2S: ácido sulfídrico
Repare, no caso do H2S, que não se deve utilizar o nome enxofre para nomenclatura (não se diz ácido enxofídrico), mas sim utilizar o verbete original em latim, sulfur.
Um caso de hidrácido que chama a atenção é o caso do ácido cianídrico, HCN, uma espécie ácida que tem o ânion composto cianeto (CN−).
Nomenclatura dos oxiácidos
Os oxiácidos são as espécies ácidas que, além do hidrogênio, têm o oxigênio em sua constituição. Esses compostos devem iniciar sua nomenclatura oficial com o termo ácido sucedido pelo nome do elemento com o sufixo -oso ou com o sufixo -ico.
Isso ocorre porque, diferentemente dos hidrácidos, um mesmo elemento pode formar mais de um oxiácido, havendo necessidade de diferenciar por meio dos sufixos -oso (quando a espécie tem menor teor de oxigênio ou o elemento central tem menor número de oxidação) e -ico (quando a espécie tem maior teor de oxigênio ou o elemento central tem maior número de oxidação). Caso o elemento só tenha uma única possibilidade de oxiácido, utiliza-se o sufixo -ico para tal. São exemplos:
- H2CO3: ácido carbônico
- H3BO3: ácido bórico
- HNO3: ácido nítrico (o nox do nitrogênio é +5)
- HNO2: ácido nitroso (o nox do nitrogênio é +3)
- H3PO4: ácido fosfórico (o nox do fósforo é +5)
- H3PO3: ácido fosforoso (o nox do fósforo é +3)
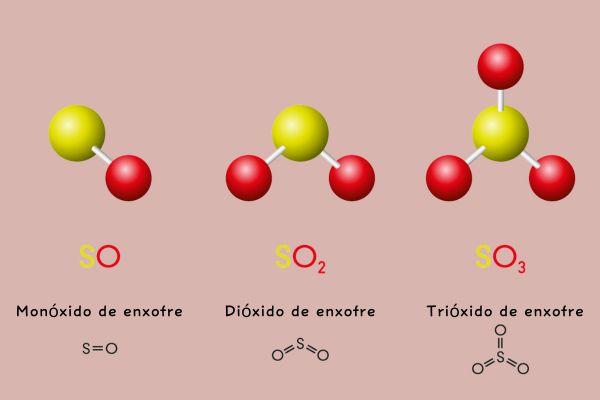
- H2SO4: ácido sulfúrico (o nox do enxofre é +6)
- H2SO3: ácido sulfuroso (o nox do enxofre é +4)
O ácido fosfórico tem uma questão relacionada ao seu grau de hidratação. O que ocorre é que esse oxiácido pode estar mais ou menos hidratado, dando origem, além da tradicional e mais conhecida H3PO4, às espécies HPO3 e H4P2O7.
O H3PO4 é a forma mais hidratada entre os ácidos fosfóricos, por isso, pode ser chamado de ácido ortofosfórico. Contudo, justamente por ser o mais hidratado (e o mais comum), o prefixo orto- pode ser omitido. Já o HPO3 é obtido por meio da desidratação do H3PO4, sendo conhecido como ácido metafosfórico.
Os elementos do grupo 17 (halogênios) podem formar até quatro oxiácidos, com números de oxidação +1, +3, +5 e +7 para o elemento central (a exceção é o flúor, que só forma uma única espécie). Para diferenciá-los, utiliza-se os prefixos hipo- (quando tem menor teor de oxigênio ou menor número de oxidação do elemento central em relação ao ácido que termina em -oso) e per- (quando tem maior teor de oxigênio ou maior número de oxidação do elemento central em relação ao ácido que termina em -ico).
- HXO: ácido hipo ...oso, em que X, com número de oxidação igual a +1, pode ser F, Cl, Br ou I.
- Exemplo: HFO (ácido hipofluoroso); HClO (ácido hipocloroso).
- HXO2: ácido ...oso, em que X, com número de oxidação igual a +3, pode ser Cl, Br ou I.
- Exemplo: HClO2 (ácido cloroso); HBrO2 (ácido bromoso).
- HXO3: ácido ...ico, em que X, com número de oxidação igual a +5, pode ser Cl, Br ou I.
- Exemplo: HClO3 (ácido clórico); HIO3 (ácido iódico).
- HXO4: ácido per ...ico, em que X, com número de oxidação igual a +7, pode ser Cl, Br ou I.
- Exemplo: HClO4 (ácido perclórico).
Acesse também: Como é feita a nomenclatura dos álcoois?
Exercícios resolvidos sobre a nomenclatura dos ácidos
Questão 1
(UPF)
De acordo com imagens do Inpe (Instituto Nacional de Pesquisas Espaciais), a fumaça das queimadas que devastam a Amazônia e o Pantanal começou a chegar em meados de setembro de 2021 às regiões Sul e Sudeste do país. Dados do instituto indicam que entre janeiro e agosto deste ano foram registrados 10.153 focos de incêndio no Pantanal – número superior ao total registrado entre 2014 e 2019 (10.048).
O fenômeno da chuva com comportamento ácido é causado por reações químicas que ocorrem entre alguns gases liberados na atmosfera de forma antrópica ou natural e o vapor d’água. Como consequência, há a formação de algumas substâncias de comportamento ácido, como por exemplo: ácido carbônico, ácido sulfúrico, ácido sulfuroso, dentre outros, que conferem pH abaixo de 7,0 à água da chuva.
(Fonte: https://www.cnnbrasil.com.br/nacional/chuva-escura-chamaatencao-no-rs-queimada-no-pantanal-pode-ter-causado-fenomeno).
As fórmulas moleculares dos ácidos citados no texto são, respectivamente:
- HCO3; H2SO3; HSO2.
- H2CO3; H2SO4; H2SO3.
- H2CO4; H2SO3; H2SO3.
- H2CO3; H2SO3; H2SO4.
- H2CO4; H2SO4; H2S.
Resolução:
Alternativa B
O ácido carbônico é o único oxiácido do carbono, apresentando fórmula H2CO3. Nesse ácido, o número de oxidação do carbono é +4.
Já o ácido sulfúrico e o ácido sulfuroso são os oxiácidos do enxofre, sendo que o sulfúrico é o que tem maior teor de oxigênio, tendo o enxofre nox +6, H2SO4, e o sulfuroso é o que tem menor teor de oxigênio, tendo o enxofre com nox +4, H2SO3.
Questão 2
(Urca) Substâncias oxidantes tem importância fundamental nos processos químicos, umas das substâncias mais oxidantes que existe é a água régia, consiste em uma solução formada por três partes de ácido clorídrico e uma parte de ácido nítrico, sendo uma mistura capaz de atacar o ouro.
As fórmulas das substâncias destacadas são, respectivamente:
- Au, HClO3 e HNO3.
- HClO3, HNO2 e Au
- HClO3, HNO3 e Hg
- HCl, HNO3 e Au
- HCl, HNO3 e Hg
Resolução:
Alternativa D
O ácido clorídrico é um hidrácido do cloro, sendo representado pela fórmula HCl. Já o ácido nítrico é o oxiácido de nitrogênio com maior teor de nitrogênio, tendo o nox +5 para esse elemento, HNO3. E o ouro é um elemento representado pelo símbolo Au.
Fontes
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY. Nomenclature of Inorganic Chemistry: IUPAC Recommendations 2005. RSC Publishing: Londres, 2005.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
SOUZA, C. R.; SILVA, F. C. Discutindo o contexto das definições de ácido e base. Química Nova na Escola, v. 40, n. 1, p. 14-18, fev. 2018.