Ionização
A ionização ocorre quando colocamos uma substância molecular (que não possui íons) na água e há uma reação com resultante formação de íons que conduzem eletricidade.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
A ionização é um fenômeno que ocorre quando uma substância molecular entra em contato com a água, reagindo e formando íons.
Todo átomo no estado fundamental é eletricamente neutro, pois ele possui a mesma quantidade de prótons (partículas positivas) e elétrons (partículas negativas). Entretanto, ao perder ou ganhar elétrons, tais átomos tornam-se espécies químicas eletricamente carregadas, que são denominadas de íons.
Se o átomo perder um ou mais elétrons, ele ficará carregado positivamente (pois a sua quantidade de cargas positivas (prótons) será maior) e será chamado de cátion. Por outro lado, se o átomo ganhar um ou mais elétrons, ele ficará carregado negativamente (pois a sua quantidade de cargas negativas (elétrons) será maior) e será chamado de ânion.
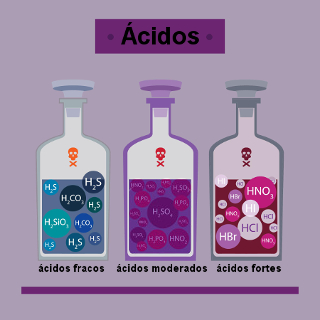
Isso também ocorre com as substâncias, ou seja, elas são eletricamente neutras, mas podem também formar íons. O cientista sueco Svante Arrhenius verificou isso ao realizar testes de condutividade elétrica de soluções químicas. Ele verificou que as soluções moleculares, isto é, aquelas formadas por meio de ligações covalentes, em que há compartilhamento de elétrons, não possuem íons inicialmente. Mas todas as substâncias moleculares inorgânicas, como os ácidos, formam íons em contato com a água.
Veja um exemplo: o gás clorídrico (HCl(g)) é um composto inorgânico formado pelo compartilhamento de um par de elétrons entre o hidrogênio e o cloro, como mostrado abaixo:
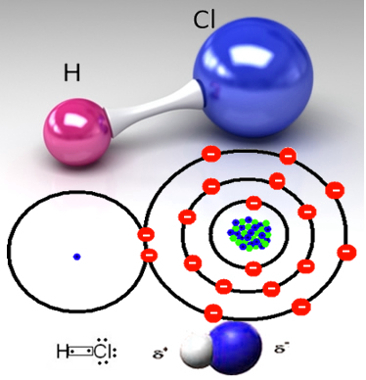
Ligação covalente formando HCl
Veja que realmente não há íons nessa substância, pois não foi formada com ligações iônicas em que há transferência de elétrons. Porém, quando Arrenius colocou o gás clorídrico na água, formando o ácido clorídrico (HCl(aq)), ele usou uma aparelhagem semelhante à mostrada mais abaixo, onde ele viu que a lâmpada conectada à solução ligou, o que significava que havia espécies químicas carregadas eletricamente na solução (íons) que conduziam a corrente elétrica.
Aconteceu a ionização do HCl da seguinte forma: essa substância é polar, tendo em vista que o Cl é mais eletronegativo que o H, ou seja, ele atrai mais fortemente os elétrons da ligação covalente para si, formando um dipolo elétrico na molécula, sendo que a sua região adquire uma carga parcial negativa (δ-), enquanto o hidrogênio adquire uma carga parcial positiva (δ+).
A água (H2O) também é polar, pois o oxigênio é mais eletronegativo que o hidrogênio e forma-se também um dipolo elétrico em suas moléculas.
Assim, quando o HCl é colocado em contato com a água, ela atua como reagente, sendo que o hidrogênio positivamente carregado do HCl é fortemente atraído pelo oxigênio da água, tendo em vista que o oxigênio é ainda mais eletronegativo que o cloro. Com isso, a molécula de HC? é quebrada, o hidrogênio liga-se à molécula de água, formando o cátion hidrônio (H3O+(aq)), e o cloro fica com carga negativa, formando o ânion cloreto (Cl-(aq)):
HCl(g) + H2O(l) → H3O+(aq) + Cl-(aq)
Esse fenômeno pode ser representado mais simplificadamente por:
HCl(g) → H+(aq) + Cl-(aq)
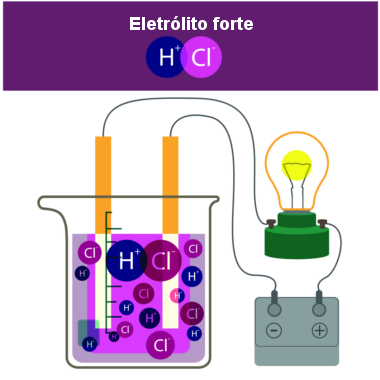
Formação de íons em solução pela inserção do HCl na água
Mas, na realidade, o que acontece é que o cátion hidrônio (H3O+(aq)) fica envolto por mais três moléculas de água, formando o cátion hidroxônio (H9O4+(aq)), mas não se costuma representar essa reação de ionização assim.
Todo ácido sofre ionização. No caso da maioria das bases, elas já são iônicas, portanto, no caso delas, não ocorre uma ionização, mas sim uma dissociação iônica.
Vale lembrar que toda substância molecular inorgânica sofre ionização, o que não ocorre com toda substância molecular orgânica. Por exemplo, o ácido acético ou ácido etanoico (CH3COOH) é um composto orgânico que, em solução, forma os íons CH2COO- e H+:
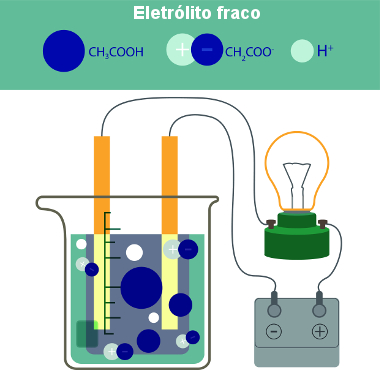
Formação de íons em solução pela inserção de ácido acético na água
No entanto, quando a sacarose (açúcar - C12H22O11) é colocada em água, não se formam íons, ela apenas se dissolve, originando uma solução molecular não eletrolítica, isto é, que não conduz eletricidade.
Aproveite para conferir nossas videoaulas sobre o assunto: