Nomenclatura de sais duplos
A nomenclatura dos sais duplos facilita o reconhecimento desses sais em meio a todos os outros integrantes desse grupo de substâncias inorgânicas.
Por Diogo Lopes Dias

PUBLICIDADE
O conhecimento a respeito dos sais é muito importante de uma forma geral. Sabe-se que esses compostos estão relacionados com vários processos industriais diferentes, que, por sua vez, estão relacionados de forma direta ou indireta com o dia a dia das pessoas.
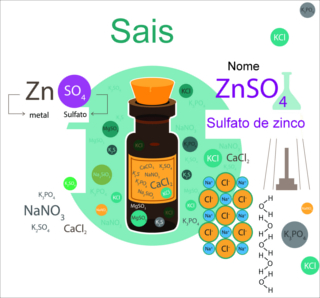
Conhecer os sais abrange várias questões, como as suas características químicas, físicas, classificação e nomenclatura. Especificamente em relação à nomenclatura dos sais, temos a seguinte regra geral:
Nome do ânion + de + nome do cátion
Ex: NaI → Iodeto de sódio (o ânion I- é o iodeto e o cátion Na+ é o sódio)
Mas essa regra de nomenclatura só é efetiva para aqueles sais que são classificados como sais simples, ou seja, os sais que, em água, dissociam-se e formam apenas um cátion e um ânion. Por exemplo:
NaI(aq) → Na+(aq)+ I-(aq)
Quando trabalhamos com um sal chamado de duplo, por exemplo, essa regra passa por alguns ajustes. Mas o que seria um sal duplo? Trata-se daquele que apresenta em sua constituição a presença de dois cátions acompanhando um ânion ou dois ânions acompanhando um cátion. Por essa razão, quando esses sais sofrem o fenômeno da dissociação em água, eles liberam dois cátions ou dois ânions, a depender do sal com o qual se está trabalhando.
O sal duplo que apresenta em sua constituição dois cátions acompanhando um ânion é chamado de sal duplo quanto ao cátion. Para realizar a nomenclatura de um sal desse tipo, devemos utilizar a seguinte regra de nomenclatura:
Nome do ânion + (duplo) + de + nome dos dois cátions (separados pela conjunção e)
OBS.¹: O nome de cada cátion é escrito de acordo com a ordem de eletropositividade. Assim, o cátion mais eletropositivo será escrito primeiro.
Veja alguns exemplos de nomenclatura de sais duplos quanto ao cátion:
-
NaNH4SO4 → Sulfato (duplo) de sódio e amônio
-
KMgPO4 → Fosfato (duplo) de potássio e magnésio
-
CaZnP2O7 → Pirofosfato (duplo) de cálcio e zinco
-
AgFeBO3→ Borato (duplo) de prata e ferro III
Já o sal duplo que apresenta na sua constituição dois ânions acompanhando um cátion é chamado de sal duplo quanto ao ânion. Para realizar a nomenclatura de um sal desse tipo, devemos utilizar a seguinte regra de nomenclatura.
Nomes dos ânions (separados por um hífen) + de + nome do cátion
OBS2: O nome de cada ânion será escrito de acordo com a ordem de eletronegatividade. Assim, o cátion mais eletronegativo será escrito primeiro.
Veja alguns exemplos de nomenclatura de sais duplos quanto ao ânion:
-
CaClBr → Cloreto-brometo de cálcio
-
MgNO3Cl → Cloreto-nitrato de magnésio
-
FeISO4 → Iodeto-sulfato de ferro III
-
TiPO4CN → Fosfato-cianeto de titânio IV
Por Me. Diogo Lopes Dias
Videoaula relacionada: