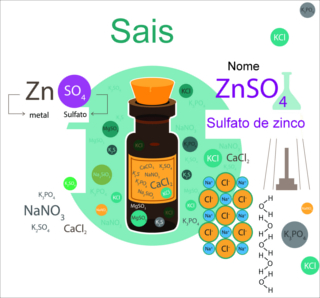
Classificação dos sais
A classificação dos sais pode ser feita principalmente de acordo com a sua solubilidade e com os tipos de íons provenientes do ácido e da base que os formaram.
Por Jennifer Rocha Vargas Fogaça
PUBLICIDADE
Os sais inorgânicos podem ser classificados de acordo com vários critérios, sendo que um modo é pelo número de elementos que os constituem. Por exemplo, se o sal é formado por apenas dois tipos de elementos, então ele é classificado como um sal binário (NaCl, LiCl, KI); se tiver três elementos, é um sal ternário (KNO2, Ca3(PO4)2, CuSO4, Al2(SO4)3), e se for constituído por quatro elementos, será um sal quaternário (NaHCO3, Al(OH)2Cl, Na2HPO4).
No entanto, as formas mais importantes de classificação dos sais é de acordo com os íons que os formam e de acordo com a solubilidade em água. Veja cada caso:
-
De acordo com os íons que os formam:
Os sais inorgânicos são sempre formados pela reação de neutralização entre ácidos e bases. O cátion (espécie química com carga positiva) que forma o sal é proveniente da base, enquanto o ânion (espécie química com carga negativa) é proveniente do ácido, conforme mostrado abaixo:
HA + BOH → AB + H2O
Ácido + Base → Sal + Água
Assim, dependendo do tipo de ácido e de base que reage, a solução aquosa do sal formado pode ser classificada como neutra, ácida ou básica:
* Sal Neutro: Formado pela reação entre ácido forte e base forte.
Exemplo: HCl + NaOH → NaCl + H2O
Ácido + Base → Sal + Água
forte forte neutro
Esse tipo de sal é considerado neutro porque, visto que o ácido e a base são fortes, os seus íons ionizam-se e dissociam-se completamente, e quando os sais formados por esses íons são adicionados na água, eles não sofrem hidrólise e, portanto, não alteram o pH do meio.
* Sal básico ou hidroxissal: Formado pela reação entre base forte e ácido fraco.
Exemplo: CH3COOH+ NaOH → NaOOCCH3 + H2O
Ácido + Base → Sal + Água
fraco forte básico
O ânion desses sais que são provenientes do ácido fraco sofre hidrólise em meio aquoso e origina íons hidroxila (OH-), tornando o meio básico (pH > 7).
* Sal ácido ou hidrogenossal: Formado pela reação entre ácido forte e base fraca.
Exemplo: HCl + NH4OH →NH4Cl + H2O
Ácido + Base → Sal + Água
forte fraca ácido
No caso do sal ácido, o cátion que é proveniente da base fraca sofre hidrólise em meio aquoso e altera o pH do meio, tornando-o inferior a 7, ou seja, torna-se ácido.
Quando a base e o ácido são ambos fracos, o pH da solução do sal formado será neutro, ácido ou básico, dependendo da força relativa do ácido-base conjugado.
Ainda de acordo com o tipo de íons dos sais, podemos ter também as seguintes classificações:
* Sal misto ou duplo: Quando libera em meio aquoso dois ânions ou dois cátions diferentes.
Exemplos:
KNaSO4: possui dois cátions →K+ e Na+; ânion → SO42-;
CaCl(ClO): possui dois ânions → Cl- e ClO-; cátion → Ca+.
* Sal hidratado: Quando possui moléculas de água encrustadas no retículo cristalino em uma proporção definida.
Exemplos: CuSO4 . 5 H2O - sulfato de cobre II penta-hidratado;
CaSO4 . 2 H2O – sulfato de cálcio di-hidratado.
Quando o sal não possui água em seu retículo cristalino, ele é denominado de sal anidro.
* Alúmen: Esse sal é o mais complexo, pois ele possui dois cátions, sendo um monovalente (com carga +1) e o outro trivalente (com carga +3), um ânion e ainda é hidratado.
Exemplos: KAl(SO4)2 . 12 H2O – sulfato duplo de potássio e alumínio dodeca-hidratado (pedra-ume).
-
De acordo com a solubilidade em água:
Abaixo temos uma relação da solubilidade dos sais mais comuns em água considerando a temperatura de 25 ºC e a pressão de 1 atm. Quando se diz que o sal é insolúvel, na verdade significa que ele possui uma solubilidade extremamente pequena, pois, na verdade, todos os sais são solúveis em água.
-
Acetatos (CH3COO-) → Solúveis → Exceções: Acetato de prata (solúvel parcialmente); acetato de mercúrio I (solúvel parcialmente) e acetato de estanho II (decompõe-se em água);
-
Brometos (Br-) → Solúveis → Exceções: Antimônio e bismuto (decompõem-se em água), ouro I e platina (solúveis parcialmente), e prata e mercúrio I (insolúveis);
-
Carbonatos (CO32-) → Insolúveis → Exceções: Amônio, sódio e potássio (solúveis), e lítio (solúvel parcialmente);
-
Cianetos (CN-) → Insolúveis → Exceções: Amônio, metais alcalinos e metais alcalinoterrosos;
-
Cloratos (ClO3-) → Solúveis;
-
Cloretos (Cl-) → Solúveis → Exceções: Prata e mercúrio I (insolúveis), chumbo II e ouro I (solúveis parcialmente), e cromo III (solúvel parcialmente e de forma lenta);
-
Cromatos (CrO42-) → Insolúveis → Exceções: Amônio e metais alcalinos;
-
Dicromatos (Cr2O72-) → Insolúveis → Exceções: Amônio e metais alcalinos (solúveis);
-
Ferricianetos [Fe(CN)6]3- → Insolúveis → Exceções: Amônio e metais alcalinos (solúveis);
-
Ferrocianetos [Fe(CN)6]4- → Insolúveis → Exceções: Amônio e metais alcalinos (solúveis);
-
Fluoretos (F-) → Insolúveis → Exceções: Amônio e metais alcalinos (solúveis);
-
Fosfatos (PO43-) → Insolúveis → Exceções: Amônio e metais alcalinos (solúveis);
-
Hidrogenocarbonatos (HCO3-) → Solúveis;
-
Hidrogenofosfatos (H2PO4- e HPO42-) → Solúveis;
-
Hidrogenossulfatos (HSO42-) → Solúveis;
-
Hidróxidos (OH-) → Insolúveis → Exceções: Amônio e metais alcalinos (solúveis), cálcio, bário e estrôncio (solúveis parcialmente);
-
Iodetos (I-) → Solúveis → Exceções: Prata, chumbo II e cobre I.
-
Nitratos (NO3-) → Solúveis;
-
Nitritos (NO2-) → Solúveis;
-
Oxalatos (C2O42-) → Insolúveis → Exceções: Amônio e metais alcalinos;
-
Óxidos (O2-) → Insolúveis → Exceções: Metais alcalinos (solúveis); cálcio, bário e estrôncio (solúveis parcialmente);
-
Percloratos (ClO4-) → Solúveis → Exceções: Potássio e mercúrio I (insolúveis);
-
Permanganatos (MnO4-) → Solúveis;
-
Silicatos (SiO32-) → Insolúveis → Exceções: Sódio, potássio e bário (solúveis), cálcio (solúvel parcialmente);
-
Sulfatos (SO42-) → Solúveis → Exceções: Estrôncio e bário (insolúveis), cálcio, estrôncio, prata e mercúrio I (solúveis parcialmente); mercúrio II (decompõe-se em água);
-
Sulfetos (S2-) → Insolúveis → Exceções:Amônio e metais alcalinos (solúveis); cálcio, bário e estrôncio (solúveis parcialmente);
-
Sulfitos (SO32-) → Insolúveis → Exceções: Amônio e metais alcalinos;
-
Tiocianatos (SCN-) → Insolúveis → Exceções: Amônio e metais alcalinos;
-
Tiossulfatos (S2O32-) → Insolúveis → Exceções: Amônio e metais alcalinos.
Por Jennifer Fogaça
Graduada em Química
Aproveite para conferir nossa videoaula sobre o assunto: