Cálculo do Kps
O cálculo do Kps leva em consideração a concentração em mol/L de cada um dos íons presentes na solução.
Por Diogo Lopes Dias

PUBLICIDADE
Para saber como realizar o cálculo do Kps, é fundamental entender bem o seu significado. Kps é a sigla que representa a constante do produto de solubilidade, utilizada quando há equilíbrio químico em uma solução formada por um soluto que apresenta baixa solubilidade em um determinado solvente.
Se prepararmos, por exemplo, uma solução com 1 grama de sulfato de bário em 100 mL água, sabendo que sua solubilidade em água é de 0.000285 g/100 mL, teremos então uma solução saturada com corpo de fundo.
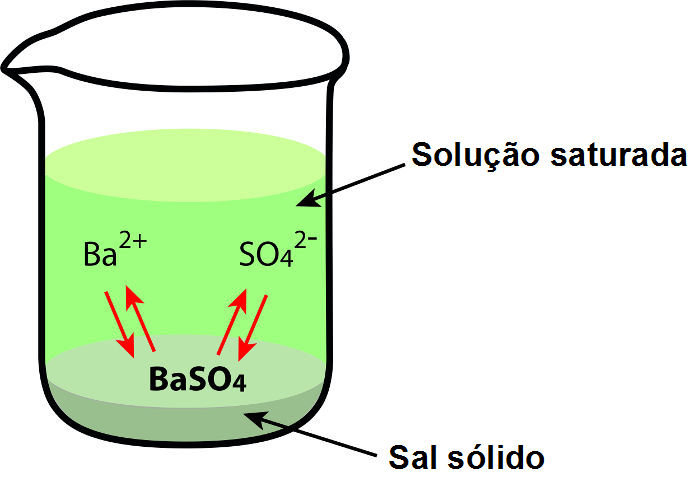
Representação de uma solução saturada com corpo de fundo
Nessa situação, podemos realizar o cálculo do Kps porque existe um equilíbrio de dissolução, no qual o corpo de fundo sofre dissociação e os íons voltam a unir-se e formar os cristais do sal novamente, com a mesma velocidade, o que provoca o seguinte equilíbrio:
BaSO4(s) → Ba+2(aq) + SO4-2(aq)
A montagem da expressão para o cálculo do Kps segue o padrão de todo equilíbrio químico, ou seja, multiplica-se a concentração molar dos produtos, sobre a concentração molar dos reagentes, elevados aos seus respectivos coeficientes estequiométricos:
Kps = [Ba+2].[SO4-2]
Como na expressão do equilíbrio químico o participante sólido não entra, assim, no Kps, haverá apenas a multiplicação entre os íons dissolvidos.
Exemplo: Montagem da expressão para o cálculo do Kps da solução formada pelo cloreto de chumbo II em água.
PbCl2(s) → Pb+2(aq) + 2 Cl-1(aq)
A expressão para o cálculo do Kps do cloreto de chumbo II terá a concentração do cátion chumbo II (Pb+2) elevado a 1, multiplicando a concentração do ânion cloreto (Cl-1) elevado a 2.
Kps = [Pb+2].[Cl-1]2
A seguir, veja alguns exemplos do cálculo do Kps.
1º Exemplo: O sulfato de bário é um sal muito utilizado como contraste para a realização de exames de raios X do trato intestinal. Por ser um sal pouco solúvel, o paciente não fica tão exposto aos cátions bário (os quais apresentam alta toxicidade). Sabendo-se que 6 g de BaSO4 pode ser dissolvido em 2000 L de água, podemos afirmar que o produto de solubilidade (Kps) aproximado para esse sal é de:
a) 2,50 .10–3.
b) 1,70 .10–8.
c) 1,14 .10–5.
d) 1,14 .10–10.
e) 2,50 .10–10.
Para realizar o cálculo do Kps, devemos realizar os seguintes passos:
1º Passo: Calcular a massa molar do sal.
Para determinar a massa molar do sal, basta multiplicar a massa do elemento pela sua quantidade de átomos na fórmula e, em seguida, somar todos os resultados:
M1 = 1.137 + 1.32 + 4.16
M1 = 137 + 32 + 64
M1 = 233 g/mol
2º Passo: Calcular a concentração molar do sal.
Para isso, basta utilizar a massa e o volume fornecidos pelo exercício, juntamente com a massa molar encontrada no primeiro passo, na expressão abaixo:
M = m 1
M1.V
M = 6
233.2000
M = 6
46600
M = 1,3.10-4 mol/L
3º Passo: Montar a equação de dissociação para o sal.
BaSO4(s) → 1 Ba+2(aq) + 1 SO4-2(aq)
4º Passo: Determinar as concentrações molares dos íons liberados pelo sal.
Para tal, devemos multiplicar a concentração molar do sal pelo coeficiente estequiométrico do íon na equação. A concentração molar do sal é de 1,3.10-4 mol/L, e os coeficientes estequiométricos dos íons Ba+2 e SO4-2 são, respectivamente, 1 e 1. Assim:
-
[Ba+2]= 1,3.10-4 mol/L
-
[SO4-2] = 1,3.10-4 mol/L
5º Passo: Montar a expressão para o cálculo do Kps para o sal.
Kps = [Ba+2]1.[SO4-2]1
6º Passo: Cálculo do Kps
Para isso, basta utilizar os valores das concentrações molares dos íons, encontrados no segundo passo, na expressão encontrada no terceiro passo:
Kps = [Ba+2]1.[SO4-2]1
Kps = [1,3.10-4]1.[1,3.10-4 ]1
Kps = [1,3.10-4].[1,3.10-4 ]
Kps = 1,69.10–8 mol/L
2º Exemplo: (UFGD-MS) Sabe-se que a solubilidade de algumas substâncias varia em função da temperatura. A fim de evitar erros experimentais, os químicos normalmente mantêm a temperatura constante durante os experimentos. Em uma determinada temperatura, a solubilidade do sulfato de prata (Ag2SO4) em água é 2,0.10–2 mol/L. Qual é o valor do produto de solubilidade (Kps) desse sal, considerando essa mesma temperatura?
a) Kps = 6,4.10–5
b) Kps = 3,2.10–5
c) Kps = 32.10–5
d) Kps = 64.10–5
e) Kps = 0,64.10–5
Para realizar o cálculo do Kps, devemos realizar os seguintes passos:
1º Passo: Montar a equação de dissociação para o sal.
Ag2SO4(s) → 2 Ag+1(aq) + 1 SO4-2(aq)
2º Passo: Determinar as concentrações molares dos íons liberados pelo sal.
Para tal, devemos multiplicar a concentração molar do sal pelo coeficiente estequiométrico do íon na equação. O exercício indicou que a concentração molar do sal é de 2,0.10–2 mol/L, e 2 e 1 são, respectivamente, os coeficientes estequiométricos dos íons Ag+1 e SO4-2. Logo:
-
[Ag+1] = 4,0.10–2 mol/L
-
[SO4-2] = 2,0.10–2 mol/L
3º Passo: Montar a expressão para o cálculo do Kps para o sal.
Kps = [Ag+1]2.[SO4-2]
4º Passo: Cálculo do Kps.
Para isso, basta utilizar os valores das concentrações molares dos íons, encontrados no segundo passo, na expressão encontrada no terceiro passo:
Kps = [Ag+1]2.[SO4-2]
Kps = [4,0.10–2 ]2.[2,0.10–2 ]
Kps = [16.10–4].[2,0.10–2 ]
Kps = 32.10–6 mol/L
ou
Kps = 3,2.10–5 mol/L
3º Exemplo: (Uniube-MG) Os íons cálcio e ácido oxálico, presentes na alimentação humana, podem, através de uma reação de precipitação oriunda das atividades fisiológicas do organismo, produzir o oxalato de cálcio, um dos principais constituintes dos cálculos renais (pedra nos rins). As medidas laboratoriais indicam que a concentração média desse sal na urina de uma pessoa adulta sem distúrbios metabólicos é da ordem de 6,7 mg/L. Sendo assim, podemos afirmar que, à temperatura corpórea, 37 ºC, o produto de solubilidade (Kps) do oxalato de cálcio para um paciente metabolicamente compensado é de, aproximadamente:
Dados: CaC2O4, M = 128 g/mol
a) 2,7 x 10–9
b) 7,3 x 10–18
c) 2,8 x 10–8
d) 5,2 x 10–5
e) 1,1 x 10–4
Para realizar o cálculo do Kps, devemos realizar os seguintes passos:
1º Passo: Calcular a concentração molar do sal.
Para isso, basta utilizar a concentração comum e a massa molar fornecidos pelo exercício na expressão abaixo:
Obs.: Como a concentração comum está na unidade mg/L, é necessário transformá-la em g/L. Para isso, basta dividir o valor fornecido, 6,7, por 1000.
C = M.M1
0,0067 = M.128
0,0067 = M
128
M = 5,23.10-5 mol/L (aproximadamente)
2º Passo: Montar a equação de dissociação para o sal.
CaC2O4 (s) → 1 Ca+2(aq) + 1 C2O4-2(aq)
3º Passo: Determinar as concentrações molares dos íons liberados pelo sal.
Para tal, devemos multiplicar a concentração molar do sal pelo coeficiente estequiométrico do íon na equação. A concentração molar do sal é de 1,3.10-4 mol/L, e os coeficientes estequiométricos dos íons Ca+2 e C2O4-2 são iguais a 1. Assim:
-
[Ca+2]= 5,23.10-5 mol/L
-
[C2O4-2] = 5,23.10-5 mol/L
4º Passo: Montar a expressão para o cálculo do Kps para o sal.
Kps = [Ca+2]1.[C2O4-2]1
5º Passo: Cálculo do Kps.
Para isso, basta utilizar os valores das concentrações molares dos íons, encontrados no segundo passo, na expressão encontrada no terceiro passo:
Kps = [Ca+2]1.[C2O4-2]1
Kps = [5,23.10-5]1.[5,23.10-5]1
Kps = [16.10–4].[2,0.10–2 ]
Kps = 27,3529 .10-10mol/L
ou
Kps = 2,73529 .10-9mol/L