Constante de ionização
A constante de ionização é a forma utilizada para expressar a constante de equilíbrio, que está relacionada à concentração em quantidade de matéria de um ácido ou uma base durante esse processo.
Por Diogo Lopes Dias

PUBLICIDADE
Constante de ionização (Ki) é uma grandeza matemática utilizada para referir-se a um equilíbrio iônico (apresenta cátion e ânion), obtido a partir de uma dissociação ou ionização.
Independentemente do equilíbrio iônico de ionização (quando um ácido é dissolvido em água) ou do equilíbrio iônico de dissociação (quando uma base é dissolvida em água), a grandeza utilizada para representá-los é a constante de ionização (Ki).
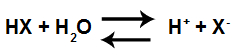
Exemplo de uma equação em equilíbrio de ionização de um ácido.
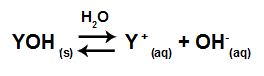
Exemplo de uma equação em equilíbrio de dissociação de uma base.
Porém, a sigla Kb (constante de dissociação da base) ou a Ka (constante de ionização do ácido) também podem ser utilizadas de forma específica para representar esses casos.
Para efetuar a constante de ionização
Assim como a constante de equilíbrio Kc, na fórmula para calcular a constante de ionização, a multiplicação entre as concentrações molares dos produtos está no numerador, e a concentração molar do ácido ou da base participante do equilíbrio está no denominador.
a) Para um ácido:
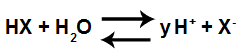
Exemplo de uma equação em equilíbrio de ionização de um ácido.
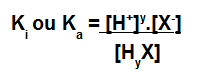
Expressão da constante de ionização para um ácido.
Obs.: y é a quantidade de hidrônios produzidos na ionização.
b) Para uma base:
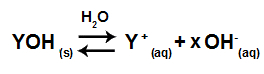
Exemplo de uma equação em equilíbrio de dissociação de uma base.
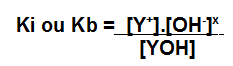
Expressão da constante de ionização para uma base.
Obs.: X é a quantidade de hidroxilas liberadas na dissociação.
Interpretações para a constante de ionização
O valor da constante de ionização é uma importante referência utilizada para classificar um ácido ou uma base quanto à força, ou seja, capacidade de se ionizar ou se dissociar quando dissolvidos em água.
a) Para os ácidos:
Os ácidos, com relação à força, são classificados em fortes (ionizam-se muito), moderados ou fracos (ionizam-se pouco). Para realizar essa classificação, basta ter o valor da constante de ionização de um ácido.
Em geral, quanto maior o valor da constante de ionização, maior será a força do ácido. Assim, são importantes os valores de Ki de ácidos diferentes para avaliar e comparar suas forças de ionização.
Porém, caso exista apenas um único ácido, considera-se forte aquele que apresenta a constante de ionização maior ou igual a 10-4 mol/L.
b) Para as bases:
As bases, com relação à força, são classificadas em fortes (dissociam-se muito) ou fracas (dissociam-se pouco). Para realizar essa classificação, basta ter o valor da constante de ionização de uma base.
Geralmente, quanto maior for o valor da constante de ionização, maior será a força da base. Assim, os valores de Ki de bases diferentes são importantes para avaliar e comparar suas forças de ionização.
Porém, caso exista apenas uma única base, considera-se forte aquela que apresenta a constante de ionização maior ou igual a 10-4 mol/L.
Exemplos de constante de ionização
1º Exemplo: Montagem da constante de ionização do ácido fosfórico (H3PO4).
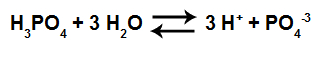
Equação em equilíbrio de ionização do ácido fosfórico.
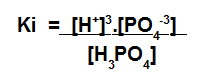
Expressão da constante de ionização do ácido fosfórico.
2º Exemplo: Classificação quanto à força de algumas bases.
Observe as bases a seguir e seus valores de constante de ionização em mol/L:
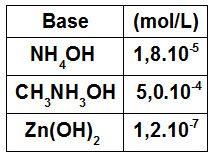
Algumas bases e suas constantes de ionização.
Analisando as constantes de ionização dessas bases, podemos ordená-las da seguinte forma decrescente (da mais forte para a mais fraca):
5,0.10-4 > 1,8.10-5 > 1,2.10-7
Cálculo da Constante de Ionização

Símbolo utilizado para a constante de ionização.
O cálculo da constante de ionização pode ser realizado tanto para um ácido quanto para uma base. No caso das bases, ela pode ser denominada constante de dissociação. Para calcular a constante de ionização, existem duas alternativas.
-
Primeira opção: utilizar a expressão da constante de equilíbrio.
Nesse caso, basta utilizar a relação entre o produto das concentrações (em mol/L) dos íons e a concentração do ácido ou da base.
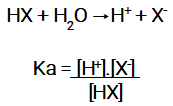
Expressão da constante de ionização de um ácido.
Obs.: A água não faz parte da expressão por ser uma variável constante.
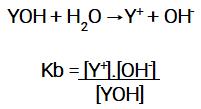
Expressão da constante de ionização de uma base.
Exemplo
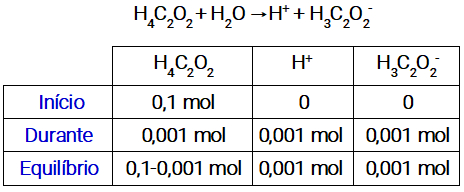
Ao dissolver 0,1 mol de ácido acético (H4C2O2) em água suficiente para um litro, constata-se que 0,06 g do ácido acético ionizou-se. Qual é o valor da constante de ionização desse ácido?
Dados
-
Número de mol inicial do ácido = 0,1 mol
-
Volume da solução = 1L
-
Massa de ácido ionizada = 0,06 g
Resolução
Passo 1: determinar a massa molar do ácido.
Basta multiplicar a quantidade de átomos do elemento pela sua massa atômica e depois somar os resultados encontrados:
Passo 2: determinar o número de mol (n) do ácido ionizado.
Basta dividir a massa (m) fornecida pela massa molar (M) do ácido:
Passo 3: montar uma tabela para determinar os valores das concentrações no equilíbrio.
Obs.: A subtração 0,1 – 0,001 mol apresenta um resultado desprezível. Por isso, durante os cálculos, vamos considerar 0,1 mol no equilíbrio para o ácido.
Passo 4: calcular a constante de ionização.
Os valores encontrados no equilíbrio acima são utilizados nesta expressão:
-
Segunda opção: utilizar a expressão da Lei de Diluição de Ostwald.
Para realizar o cálculo da constante de ionização por meio da Lei de Diluição de Ostwald, necessitamos da concentração em quantidade de matéria (representada por M) e do grau de ionização (representado por α) do ácido ou da base.

Expressões que podem ser utilizadas segundo a Lei de Diluição de Ostwald.
Exemplos
1. (UFPA) A partir da constante de ionização do ácido acético, que é igual a 1,8. 10-5, o grau de ionização de uma solução 0,045 mol/L do referido ácido é:
a) 2%
b) 4%
c) 8%
d) 20%
e) 50%
Dados
-
M (concentração) = 0,045 mol/L
-
α (grau de ionização) = ?
-
Ka (constante de ionização) ou Ki = 1,8. 10-5 mol/L
Como a constante de ionização desse ácido é baixa (10-5 ou inferior), basta utilizar os dados na fórmula a seguir:

Cálculo do grau de ionização de um ácido fraco.
2. (Cefet-PR) Calcule a constante de ionização do ácido acético, a 25°C, em uma solução 2.10-2 moI/L, sabendo que, nessas condições, o seu grau de ionização é 30%.
a) 2,6. 10-3
b) 3,7. 10-2
c) 1,4. 10-3
d) 3,2. 10-3
e) 3,1. 10-3
Dados
-
M (concentração) = 2.10-2 mol/L
-
α (grau de ionização) = 30 % ou 0,3 (após dividir por 100)
-
Ka (constante de ionização) ou Ki = ?
Como o grau de ionização desse ácido é menor que 5%, basta utilizar os dados na fórmula a seguir:
Obs.: Como o grau de ionização do ácido é maior que 5%, devemos utilizar o denominador (1- α).
3. (Fameca-SP) Calcule o valor de Ka para o HCN sabendo que o ácido em solução 0,10 mol/L encontra-se 0,006% ionizado.
a) 1,2. 10-4
b) 3,6. 10-8
c) 3,6. 10-5
d) 3,6. 10-10
e) 6,0. 10-5
Dados
-
M (concentração) = 0,1 mol/L
-
α (grau de ionização) = 0,006% ou 0,00006 (após dividir por 100)
-
Ka (constante de ionização) ou Ki = ?
Como o grau de ionização desse ácido é menor que 5%, basta utilizar os dados na fórmula a seguir:
4. (IF-Januária-MG) O ácido bórico é um ácido fraco usado em colírios e como antisséptico. Uma solução de ácido bórico a 20 °C apresenta grau de ionização de 0,075% e constante de ionização igual a 5,27. 10-10 mol/L. Calcule a concentração em quantidade de matéria do ácido bórico em solução na temperatura indicada.
Dados
-
M (concentração) = ?
-
α (grau de ionização) = 0,075% ou 0,00075 (após dividir por 100)
-
Ka (constante de ionização) ou Ki = 5,27. 10-10 mol/L
Como a constante de ionização desse ácido é baixa (10-5 ou inferior), basta utilizar os dados na fórmula a seguir:
.jpg)
Cálculo da concentração em mol/L de um ácido fraco.
Aproveite para conferir nossa videoaula sobre o assunto:

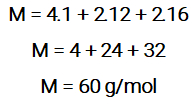
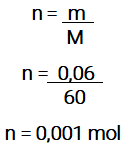
.jpg)
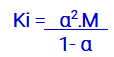
.jpg)



![Apesar de não ter sido descoberto por Avogadro, a constante leva seu nome devido à sua importante contribuição. [1] Apesar de não ter sido descoberto por Avogadro, a constante leva seu nome devido à sua importante contribuição. [1]](https://static.manualdaquimica.com/2020/01/avogrado.jpg)