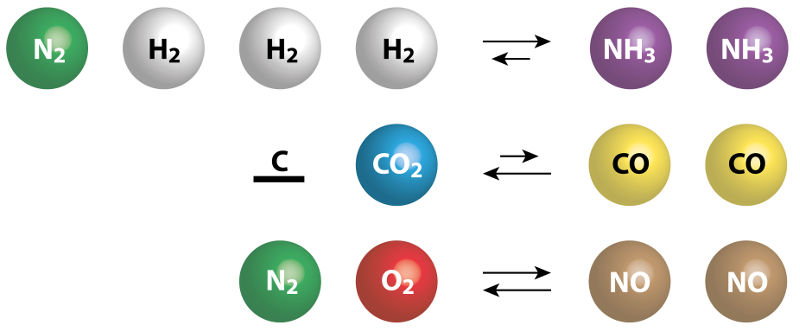
Constantes de Equilíbrio Kc e Kp
s expressões das constantes de equilíbrio químico, Kc e Kp, são características para cada reação e só variam com a temperatura.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
Os cientistas ilustrados acima são Cato Guldberg (1836-1902) e Peter Waage (1833-1900), que foram os criadores da Lei de ação das massas que permitiu formular a expressão da constante de equilíbrio. Para entender como se chegou a ela, vamos considerar a reação genérica abaixo, em que as letras minúsculas referem-se aos coeficientes da equação química em equilíbrio, e as letras maiúsculas referem-se às substâncias que participam da reação:
a A + b B ↔ c C + d D
Quando uma reação reversível atinge o equilíbrio significa que a taxa de desenvolvimento ou a velocidade da reação direta é igual à taxa de desenvolvimento ou à velocidade da reação inversa:
VDIRETA = VINVERSA
Essas velocidades podem ser dadas por:
VDIRETA = KDIRETA . [A]a . [B]b
VINVERSA = KINVERSA . [C]c . [D]d
Assim, temos:

Observe que, desse modo, obtivemos a divisão entre duas constantes (KDIRETA/KINVERSA). Por definição, a divisão de duas constantes sempre é igual à outra constante. Essa constante nova é chamada por constante de equilíbrio e é simbolizada por “Ke”:

Visto que a constante de equilíbrio é dada em termos de concentração em quantidade de matéria (mol/L), ela é mais simbolizada por Kc:

Assim, quando for escrever a expressão da constante de equilíbrio Kc de alguma reação, deve-se dividir a concentração dos produtos no equilíbrio elevada ao seu coeficiente na equação pela concentração dos reagentes no equilíbrio também elevada ao seu coeficiente na equação:
Kc = [produtos]coeficiente na equação química balanceada
[reagentes]coeficiente na equação química balanceada
Mas é importante lembrar que somente fazem parte da expressão da constante de equilíbrio as concentrações das substâncias que podem sofrer variação, tais como soluções aquosas e gases. Visto que os sólidos não sofrem essa variação, eles não são colocados na expressão de Kc.
A concentração em mol/L pode ser dada por:
C = densidade/Massa molar
Visto que a concentração em mol/L é diretamente proporcional à densidade, e sabendo que os sólidos possuem densidade constante a uma dada temperatura, a concentração deles também é constante.
Veja agora alguns exemplos de expressões de Kc para algumas reações em equilíbrio e veja como os sólidos não participam:
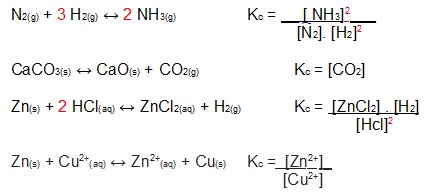
Se a equação possui pelo menos uma substância gasosa, ela pode ser expressa também em termos de pressão parcial dos gases, sendo simbolizada por Kp. A expressão de Kp é análoga à expressão de Kc, mas é necessário introduzir a pressão parcial de cada substância, simbolizada pelo “p” abaixo:

Agora veja a expressão de Kp para algumas reações em equilíbrio e observe que os sólidos e os líquidos não aparecem, pois a pressão parcial de ambos é desprezível.
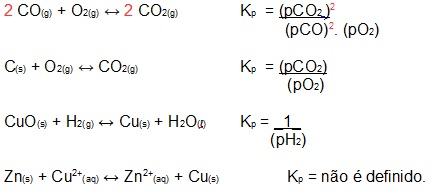
Tanto Kc quanto Kp são adimensionais, isto é, não são expressos usando unidades ligadas a alguma grandeza, mas são expressos somente pelos números puros. Além disso, ambos só variam com a variação da temperatura, sendo característicos para cada reação.
________________
* Imagem com direitos autorais: Boris15/Shutterstock.com.
Por Jennifer Fogaça
Graduada em Química
Videoaula relacionada: