Descarga seletiva de cátions e ânions
A descarga seletiva de cátions e ânions é o critério que indica quais são os íons que sofrerão oxidação e redução em uma eletrólise aquosa.
Por Diogo Lopes Dias
PUBLICIDADE
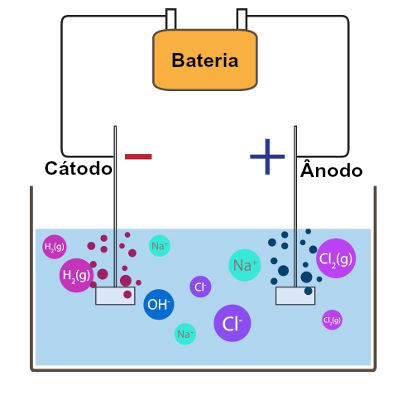
Sempre que uma eletrólise em meio aquoso está sendo realizada, a descarga seletiva de cátions e ânions é fundamental, pois, no meio (solução) em que o processo está ocorrendo, sempre existem dois cátions e dois ânions.
Como a eletrólise ocorre em meio aquoso, a água fornece o cátion hidrônio (H+) e o ânion hidróxido (OH-). O outro cátion e o outro ânion pertencem geralmente a um sal inorgânico que foi dissolvido na água, o que favorece a dissociação ou liberação de íons por parte do sal.
O termo descarga seletiva de cátions e ânions é utilizado porque apenas um dos dois cátions e um dos ânions presentes na solução serão influenciados pela corrente elétrica fornecida durante a realização da eletrólise.
Durante a eletrólise, o cátion sofre redução, e o ânion sofre oxidação. Na eletrólise em meio aquoso, apenas um dos cátions presentes sofrerá redução, assim como apenas um dos ânions sofrerá a oxidação, o que caracteriza a descarga seletiva.
Qual dos cátions sofrerá descarga seletiva?
Para saber se o hidrônio ou o outro cátion presente na solução sofrerá descarga seletiva, basta conhecer a ordem decrescente de prioridade seletiva:
Qualquer outro cátion > H+ > famílias IA, IIA ou IIIA
Quanto maior a eletropositividade do cátion, menor a chance de ele sofrer a descarga.
a) Quando o hidrônio (H+) sofre descarga seletiva
Quando o cátion hidrônio descarrega de forma seletiva, forma a substância simples gás hidrogênio (H2) em decorrência da redução, na qual o cátion recebe elétrons, como representado a seguir:
2 H+ + 2 e → H2(g)
b) Quando o ânion diferente do hidrônio sofre descarga seletiva
Quando um cátion (Y+) diferente do hidrônio descarrega de forma seletiva, forma uma substância simples metálica (geralmente sólida, com exceção do mercúrio, que é líquido), também em decorrência do fenômeno da redução, como representado a seguir:
Y+ + e → Y(s)
Qual dos ânions sofre descarga?
Para saber se o hidróxido ou o outro ânion presente na solução sofrerá descarga seletiva, basta conhecer a ordem decrescente de prioridade seletiva:
Ânions não oxigenados > OH- > Ânions oxigenados ou o Fluoreto (F-)
Quanto maior a eletronegatividade do ânion, menor a chance de ele sofrer a descarga.
a) Quando o hidróxido (OH-) sofre descarga seletiva
Quando o ânion hidróxido descarrega de forma seletiva, forma a substância simples gás oxigênio (O2) e a substância composta água em decorrência da oxidação, na qual o ânion perde elétrons, como representado a seguir:
2 OH- → ½ O2(g) + 2e + 1 H2O
b) Quando o ânion diferente do hidróxido sofre descarga seletiva
Quando um ânion (X-) diferente do hidróxido descarrega de forma seletiva, forma uma substância simples ametálica (líquida se for o mercúrio, gasosa se for flúor ou cloro, e sólida se for qualquer outra) também em decorrência do fenômeno da oxidação, como representado a seguir:
2X- → X2 + 2e
OBS.: Comumente as substâncias simples originadas por ametais apresentam índice 2, como na equação acima.
Exemplos de aplicação da descarga seletiva de cátions e ânions
→ Eletrólise em meio aquoso do cloreto de cobre II (CuCl2)
O sal cloreto de cobre II, em meio aquoso, dissocia-se e libera o cátion cobre II (Cu+2) e o ânion cloreto (Cl-), e a água fornece o cátion hidrônio (H+) e o ânion hidróxido (OH-). Com base na descarga seletiva, temos:
- Redução: O cation cobre II sofre redução porque não pertence às famílias IA, IIA e IIIA. Veja a equação que representa o processo:
Cu2+ + 2e → Cu(s)
- Oxidação: O ânion cloreto (Cl-) sofre oxidação porque é um ânion não oxigenado. Veja a equação que representa o processo:
2 Cl- → 2 e + Cl2(g)
→ Eletrólise em meio aquoso do iodeto de potássio (KI)
O sal iodeto de potássio, em meio aquoso, dissocia-se e libera o cátion potássio (K+) e o ânion iodeto (l-), e a água fornece o cátion hidrônio (H+) e o ânion hidróxido (OH-). Com base na descarga seletiva, temos:
- Redução: O cation hidrônio sofre redução porque o potássio (K+) pertence à família IA. Veja a equação que representa o processo:
2 H+ + 2 e → H2(g)
- Oxidação: O ânion iodeto (l-) sofre a oxidação porque é um ânion não oxigenado. Veja a equação que representa o processo:
2 Cl- → 2 e + Cl2(g)
Por Me. Diogo Lopes Dias