Oxidação e redução
A oxidação e a redução são processos físico-químicos complementares conhecidos como reações de oxirredução. Uma substância perde elétrons na oxidação e ganha elétrons na redução.
Por Jhonilson Pereira Gonçalves

PUBLICIDADE
Oxidação e redução são processos físico-químicos complementares que envolvem a transferência de elétrons entre átomos e moléculas. Nesse contexto, imagine um carro enferrujado pela ação silenciosa do tempo ou uma pilha de células que impulsiona nossos dispositivos eletrônicos — ambas são manifestações tangíveis de processos de oxidação e redução. Esses fenômenos, embora muitas vezes abstratos, permeiam nossa realidade, moldando desde reações químicas mais simples até complexos processos biológicos.
Leia também: Corrosão e proteção de metais — como evitar o desgaste?
Resumo sobre oxidação e redução
- A oxidação e a redução são processos físico-químicos complementares conhecidos como reações de oxirredução.
- Na oxidação, uma substância perde elétrons durante uma reação química.
- Na redução, uma substância ganha elétrons durante uma reação química.
- Nas reações de oxirredução, oxidação e redução ocorrem simultaneamente.
- Enquanto o agente redutor é uma substância que doa elétrons e sofre oxidação, o agente oxidante é uma substância que aceita elétrons e sofre redução.
O que é oxidação e redução?
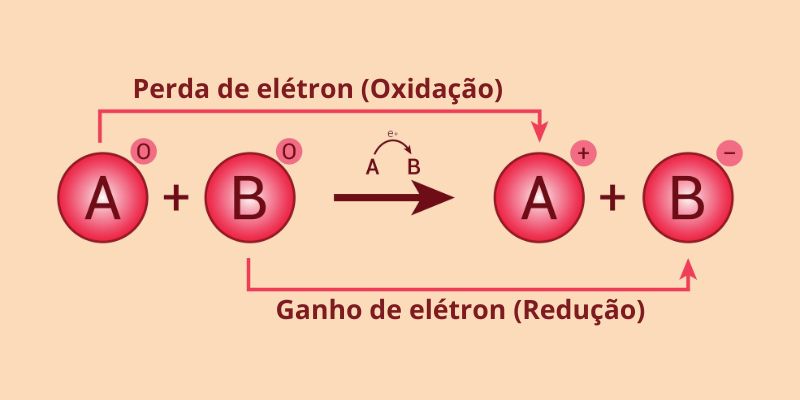
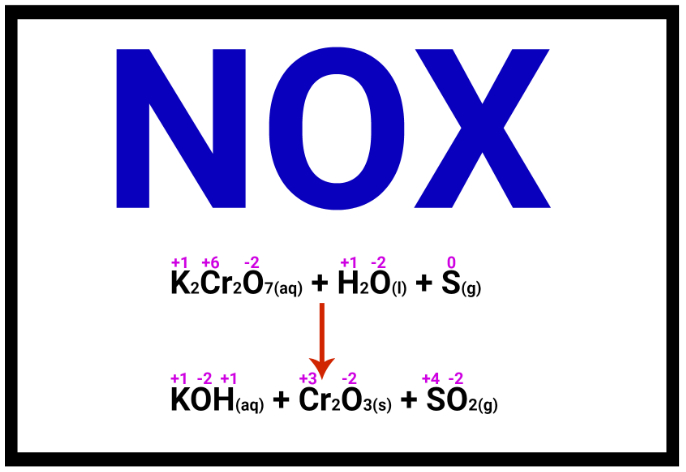
A oxidação e a redução são processos físico-químicos caracterizados pela transferência simultânea de elétrons. Na oxidação, uma substância (átomo, íon ou molécula) perde elétrons, acompanhada pelo aumento do número de oxidação (Nox). Em contrapartida, na redução, uma substância ganha elétrons, levando à diminuição do número de oxidação (Nox). Esse processo configura, assim, uma reação que pode ser denominada das seguintes formas: oxidação-redução, oxirredução ou reação redox.
Como ocorrem os processos de oxidação e de redução?
A ferramenta-chave para entender reações de oxidação e redução é o conceito de potencial redox, cujo potencial padrão de redução (Eº), valor obtido experimentalmente e tabelado para cada substância, é usado e representa a tendência de uma substância ser oxidada ou reduzida. Sendo assim, espécies com maior Eº têm maior propensão a serem reduzidas, enquanto aquelas com menor Eº são mais propensas à oxidação.
|
Semirreação de redução |
Potencial padrão de redução (Eº) |
|
O2 + 4e− + 4H+ → 2H2O |
+1,23 V |
|
Fe3+ + e− → Fe2+ |
+0,77 V |
|
Cu2+ + 2e− → Cu |
+0,34 V |
|
2H+ + 2e− → H2 |
0,00 V |
|
Zn2+ + 2e− → Zn |
-0,76 V |
|
2H2O + 2e− → H2 + 2OH− |
-0,83 V |
É importante salientar que os valores são dados em relação ao eletrodo padrão de hidrogênio (Eº = 0.00 V). Sendo assim, valores mais altos indicam uma tendência à redução, enquanto valores menores indicam uma tendência à oxidação.
→ Exemplos de como ocorrem os processos de oxidação e de redução
Vamos explorar um pouco o exemplo prático da clássica reação de oxirredução do zinco (Zn) e do cobre (Cu):
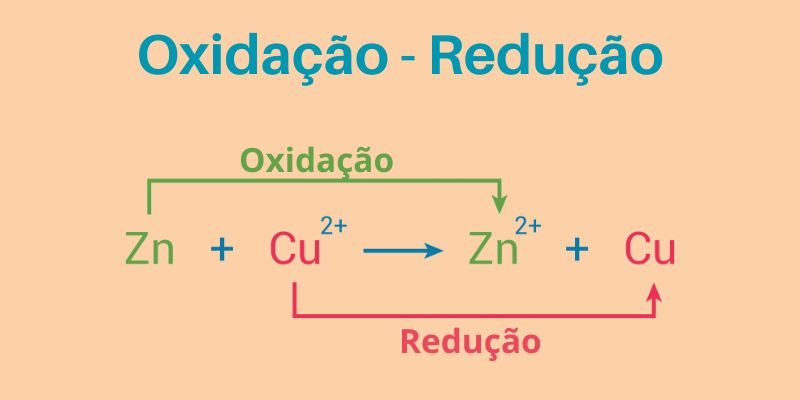
Como o zinco tem menor potencial de redução (Eº = -0,76), ele perde elétrons, passando pela oxidação enquanto, simultaneamente, o íon de cobre (Eº = 0,34º) reduz ao receber os elétrons, caracterizando-se uma reação de oxidação-redução (redox).
Outra forma de visualizarmos esse processo é por meio das semirreações de cada espécie química usadas para montar a equação global. Nesse caso, vamos considerar novamente a reação entre zinco (Zn) e cobre (Cu):
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
De forma simplificada, as semirreações mostram cada uma das reações ocorrendo separadamente. Nesse modelo, é necessário mostrar o número de elétrons envolvidos no processo.
Oxidação: Zn(s) → Zn2+ (aq) + 2e−
Redução: Cu2+(aq) + 2e− → Cu(s)
---------------------------------------------------
Zn(s) + 2Cu2+ (aq) → Zn2+ (aq) + 2Cu(s)
Perceba que, o ao perder elétrons, o Nox do zinco aumentou de 0 para 2+, logo, ele oxidou. Por outro lado, ao ganhar elétrons, o Nox do cobre diminuiu de 2+ para 0, logo, ele reduziu.
Vale lembrar que o número de elétrons transferidos na oxidação deve ser o mesmo recebido na redução, já que se trata de processos simultâneos, logo, um não existe sem o outro.
Acesse também: Como fazer o balanceamento das equações de oxirredução?
Agente oxidante e agente redutor
Agora que sabemos o que são oxidação e redução, vamos entender os conceitos de agente oxidante e de agente redutor. Sendo assim:
- Agente oxidante: é a espécie química que reduz, ou seja, ao receber elétrons de outra, ela promove a oxidação.
- Agente redutor: é a substância que oxida, sendo assim, ao doar elétrons durante a reação de oxirredução, ela promove a redução de outra substância.
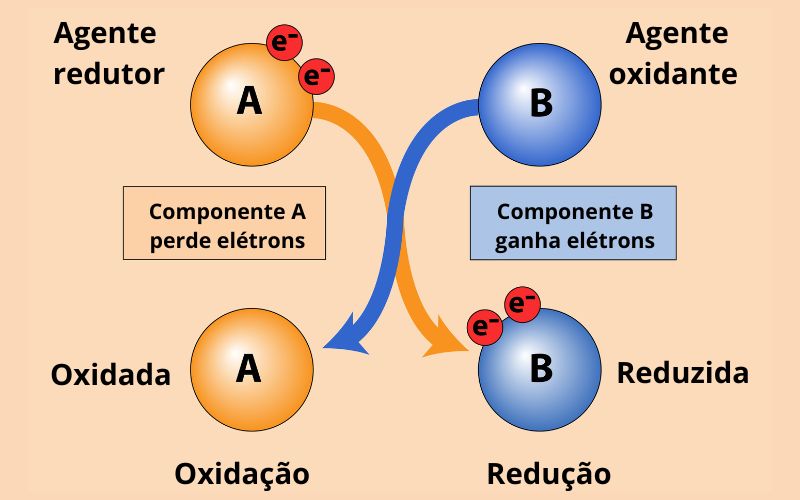
Nesse contexto, vamos voltar ao exemplo do cobre e do zinco e identificar cada um deles na reação de oxirredução.
Zn(s) + 2Cu2+ (aq) → Zn2+ (aq) + 2Cu(s)
Diante da equação global, podemos usar as semirreações para facilitar o nosso entendimento. Dessa forma, temos:
- Oxidação: Zn(s) → Zn2+ (aq) + 2e− Zn oxida à agente redutor
- Redução: Cu2+(aq) + 2e− → Cu(s) Cu2+ reduz à agente oxidante
Então fica claro que quem perde elétrons é o agente redutor e que quem ganha elétrons age como agente oxidante, certo? Vamos ver mais um exemplo. Parte superior do formulário
Considere a reação entre cobre (Cu) metálico e íons prata (Ag⁺) em uma solução aquosa:
Cu(s) + 2Ag+(aq) → Cu2+(aq) + 2Ag(s)
- Agente redutor: o cobre (Cu) é oxidado a íons Cu2+, portanto, Cu é o agente redutor, pois doa elétrons.
- Agente oxidante: íons prata (Ag+) são reduzidos à prata metálica (Ag), portanto, Ag+ é o agente oxidante, pois aceita elétrons.
Por fim, lembre-se de que não há oxidação sem redução e vice-versa.
Exercícios resolvidos sobre oxidação e redução
Questão 1
Em um experimento laboratorial, observou-se a reação entre alumínio (Al) metálico e íons de ferro (Fe³⁺). Qual das equações representa corretamente a reação de oxirredução?
A) Al(s) + 2Fe3+(aq) → Al3+(aq) + Fe(s)
B) Al(s) + Fe3+ (aq) → Al3+ (aq) + Fe2+(aq)
C) Al3+(aq) + Fe2+(aq) → Al(s) + Fe(s)
D) Al(s) + Fe3+(aq) → Al3+(aq) + Fe(s)
E) Al3+ (aq) + 3Fe3+(aq) → Al(s) + 3Fe(s)
Resolução:
Alternativa D
A alternativa D representa corretamente a transferência de elétrons, em que o alumínio (Al) é oxidado a Al3+(aq) ao doar 3 elétrons para o íon de ferro (Fe3+), que, consequentemente, é reduzido a Fe(s).
Questão 2
Considere a seguinte reação de oxirredução:
Cu2+(aq) + Zn(s) → Zn2+(aq) + Cu(s)
Identifique corretamente o agente redutor e o agente oxidante nessa reação.
A) Agente redutor: Cu2+; agente oxidante: Zn.
B) Agente redutor: Zn; agente oxidante: Cu2+.
C) Agente redutor: Cu; agente oxidante: Zn2+.
D) Agente redutor: Zn2+; agente oxidante: Cu.
E) Agente redutor: Zn; agente oxidante: Cu2+.
Resolução:
Alternativa B
A reação envolve a redução de íons cúpricos Cu2+ a cobre metálico (Cu) e a oxidação de zinco (Zn) a íons zinco (Zn2+). O agente redutor é a substância que sofre oxidação, e o agente oxidante é a substância que sofre redução.
Portanto, na reação fornecida, o zinco é o agente redutor, pois sofre oxidação (Zn → Zn2+ + 2e−), e os íons cúpricos são o agente oxidante, pois sofrem redução (Cu2+ + 2e− → Cu).Parte superior do formulário
Fontes
ANDRADE, J. C. DE. Química analítica básica. Revista Chemkeys, v. 3, 5 ago. 2021.
ATKINS, P.; JONES, L.; LAVERMAN, L. As reações redox. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. [s.l.] Bookman, 2018. p. 78–89.
L. BROWN, T. et al. Estados de oxidação e reações de oxirredução. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 894–897.