Primeira Lei de Soddy da Radioatividade
A primeira lei de Soddy diz que quando um átomo emite uma partícula alfa, seu número de massa diminui quatro unidades e seu número atômico diminui duas unidades.
Por Jennifer Rocha Vargas Fogaça
PUBLICIDADE
As emissões radioativas provocam transformações na estrutura do átomo original, mas essas modificações e decaimentos radioativos ocorrem segundo algumas leis básicas que foram estudadas principalmente por Ernest Rutherford e Frederick Soddy.
Soddy determinou exatamente o que ocorre quando um núcleo instável de um elemento radioativo emite uma partícula alfa, que é uma das três emissões radioativas naturais (as outras duas são as emissões beta e gama). Assim, ele elaborou a primeira lei da radioatividade, conhecida também como primeira lei de Soddy. Essa lei diz o seguinte:
Quando um átomo emite uma partícula alfa (α), ele transforma-se em outro átomo com o número de massa (A) quatro casas menor e com o número atômico (Z) duas casas menor.

Frederick Soddy (1877-1956) recebeu o prêmio Nobel de Química em 1921 *
Isso acontece porque, conforme explicado no texto Emissões radioativas alfa, beta e gama, a radiação alfa é igual a um núcleo de hélio, ou seja, é formada por dois nêutrons e dois prótons. Além disso, ela é representada da seguinte forma: 24α.
É necessário ressaltar que o número de massa (A) corresponde à soma dos prótons e dos nêutrons que existem no núcleo atômico (A = p + n) e, na representação dos elementos químicos, aparece na parte superior do símbolo do elemento (AX). Já o número atômico (Z) é o mesmo que o número de prótons (Z = p) e aparece na parte inferior do símbolo do elemento (ZX).
Portanto, genericamente, a primeira lei de Soddy pode ser representada pela seguinte equação nuclear:
ZAX → 24α + Z-2A-4Y
Isso significa que quando um elemento radioativo emite uma partícula 24α, o elemento obtido fica duas casas à esquerda dele na Tabela Periódica.
Por exemplo, o decaimento α do isótopo 235 do elemento urânio está representado a seguir:
92235U → 24α + 90231Th
Veja que o número de massa do tório (231) é exatamente quatro casas menor que o do urânio (235), e o número atômico do tório (90) é duas casas menor que o do urânio (90). Observe também que ocorre a conservação do número de massa e do número atômico do início ao fim do processo. Para entender, considere a seta na equação nuclear acima como se fosse “igual”, assim, teremos:
A: 235 = 4 + 231
Z: 92 = 2 + 90
Desse modo, é possível determinar os valores do número de massa ou do número atômico do elemento inicial e do elemento obtido ou mesmo descobrir qual foi a radiação emitida. Veja um exemplo:
Complete as equações nucleares a seguir:
a).... → 82207Pb + 24α
b)94239Pu → 92235U + ….
c) 89227Ac → …. + 24α
Resolução:
a).... → 82207Pb + 24α
A = 207 + 4 → A = 211;
Z = 82 + 2 → Z = 84.
O elemento inicial que sofreu o decaimento α é 84211Po, logo, a equação nuclear fica assim:
84211Po → 82207Pb + 24α
b)94239Pu → 92235U + ….
A: 239 = 235 +A → 239 – 235 = A → A = 4;
Z: 94 = 92 + Z→ 94 – 92 = Z → Z = 2;
A emissão que tem número de massa 4 e carga nuclear 2 é a partícula 24α, portanto, a equação nuclear fica assim:
94239Pu → 92235U + 24α
c) 89227Ac → …. + 24α
A: 227 = A + 4 → A = 227 – 4 → A = 223;
Z: 89= Z + 2 → Z = 89 – 2 → Z = 87.
O elemento obtido por meio desse decaimento α é 87223Fr, desse modo, a equação nuclear fica assim:
89227Ac → 87223Fr + 24α
Veja que em todos os casos o elemento obtido fica realmente duas casas à esquerda do elemento original:
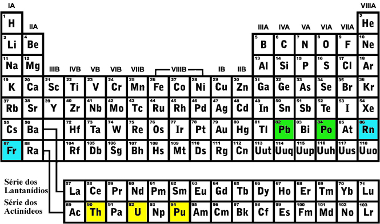
Exemplos de localização na Tabela Periódica de elementos que emitem radiação alfa e os elementos obtidos
* Crédito editorial da imagem: rook76 /shutterstock.com.
Por Jennifer Fogaça
Graduada em Química