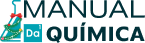Radioatividade
A radioatividade é um fenômeno de emissão de energia por núcleos atômicos sob a forma de partículas ou ondas.
Por Ana Luiza Lorenzen Lima

PUBLICIDADE
A radioatividade é um fenômeno de emissão de energia pelo núcleo de alguns átomos, sob a forma de partículas ou de onda eletromagnética. A radioatividade ocorre de modo natural para alguns elementos e pode ser forçada a ocorrer em outros.
Ela se manifesta por emissões alfa, beta ou gama. Os raios gama são altamente energéticos e possuem alto poder de penetração. As partículas alfa possuem carga positiva, maior massa e menor potencial de penetração. As partículas beta são carregadas negativamente e são mais leves do que as partículas alfa.
Os elementos radioativos possuem núcleo atômico instável e sofrem decaimento radioativo, transmutando-se em novos núcleos atômicos pela emissão de energia. A estabilidade do núcleo depende do equilíbrio entre as forças atrativas e repulsivas entre prótons e nêutrons. Núcleos com elevada quantidade de nêutrons tendem a ser instáveis. De forma ampla, elementos químicos com número atômico superior a 84 são radioativos.
Leia também: Como ocorreu o acidente com o césio-137 em Goiânia
Resumo sobre radioatividade
-
A radioatividade é um fenômeno natural de emissão de energia por um núcleo atômico, formando um novo elemento.
-
Núcleos instáveis emitem partículas alfa ou beta ou raios gama.
-
Os raios gama possuem maior poder de penetração dos que partículas alfa e beta.
-
Ao emitir partículas alfa, o núcleo atômico diminui em 4 unidades o número de massa e em 2 unidades o número atômico.
-
Ao emitir partícula beta, um núcleo atômico tem seu número de massa inalterado e seu número atômico aumentado em uma unidade.
-
A radioatividade é usada na geração de energia elétrica, em sistemas de esterilização de alimentos e utensílios médicos e em análises químicas.
-
Elementos com núcleos atômicos instáveis estão sujeitos ao decaimento radioativo.
-
Elementos com número atômico superior a 84 são radioativos.
-
Tempo de meia-vida (t1/2) é o tempo de decaimento necessário para que o núcleo atômico tenha sua concentração inicial reduzida à metade.
-
A radioatividade foi descoberta por Henry Becquerel em 1896.
O que é radioatividade?
Radioatividade é um fenômeno, natural ou artificial, em que radiação ionizante é emitida pelo núcleo de um átomo. A radiação ionizante tem energia suficiente para remover elétrons dos átomos e pode estar sob a forma de partículas ou onda eletromagnética.
No planeta Terra há 28 elementos radioativos naturais, distribuídos no ar, na água e no solo. O solo é a principal fonte de radioatividade, em razão de minerais que contêm urânio e tório. O corpo humano também pode conter elementos que emitem algum nível de radiação ionizante, como o carbono-14 e o potássio-40.
Apesar da conotação popular negativa da radioatividade, trata-se de um fenômeno que pode ser direcionado para o avanço tecnológico da sociedade. Por exemplo, elementos radioativos são a base do tratamento de alguns tipos de doenças e são aplicados para o combate de pragas no setor agrícola, conservação de alimentos, esterilização de produtos, análises na área de engenharia etc.
A radioatividade artificial é produzida pelo bombardeio dos núcleos atômicos com as partículas apropriadas, formando novos núcleos.
Quais são os tipos de radioatividade?
A radioatividade ocorre por três tipos de emissão, denominadas alfa, beta ou gama. Essas emissões têm diferentes energias de ionização e poderes de penetrabilidade na matéria também distintos.
-
Emissões alfa (α)
As emissões alfa ocorrem sob a forma de partículas e são uma radiação ionizante de elevada energia e baixo poder de penetração. Partículas alfa são formadas por dois prótons e dois nêutrons, e não possuem elétrons.
A partícula alfa, representada como \(\frac{2}{4} \alpha\), possui carga elétrica positiva e pode capturar elétrons do meio, dando origem a um átomo de hélio.
\(\frac{2}{4} \alpha + 2e^-\to\frac{2}{4}He\)
Por isso, é comum se referir à partícula alfa como um átomo de hélio com carga +2. Em razão de sua massa relativamente elevada, a penetrabilidade da partícula alfa é baixa, sendo retida por uma barreira simples, como o papel.
-
Emissões beta (β)
As emissões beta ocorrem na forma de partículas, que são relativamente leves e possuem cara elétrica negativa.
São mais penetrantes do que as partículas alfa, podendo ser retidas por uma barreira de alumínio de 5 mm ou ainda de chumbo, de 1 mm de espessura.
-
Emissões gama (γ)
As emissões gama ocorrem sob a forma de ondas eletromagnéticas. Essa radiação se manifesta sempre que há emissões alfa ou beta.
A radiação gama, por ser uma onda, não apresenta massa ou carga elétrica e possui elevado poder penetrante. Pode atravessar objetos mais densos e espessos, inclusive tecidos biológicos, chegando à região nuclear das células.
Radiação gama apenas é retida por placas de chumbo ou peças de concreto de elevada espessura.
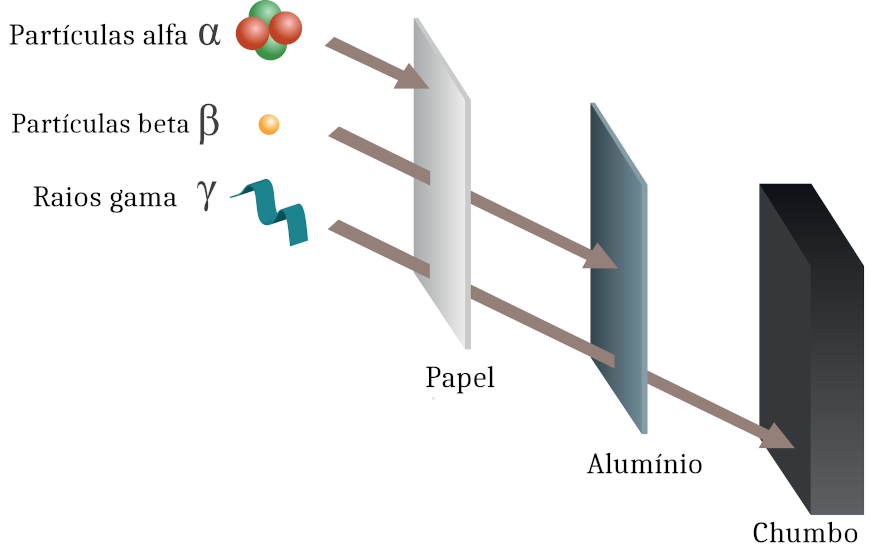
Em razão da alta energia ionizante e intenso poder de penetração, as emissões gama são empregadas em procedimentos de esterilização de alimentos e utensílios médicos.
Leis da radioatividade
Durante a descoberta e os estudos iniciais de radioatividade, algumas regularidades no comportamento dos núcleos atômicos foram sendo observadas e, posteriormente, consideradas como as leis da radioatividade.
-
1ª lei da radioatividade ou lei de Soddy
Um núcleo atômico, ao emitir partículas alfa, tem seu número de massa reduzido em 4 unidades e seu número atômico reduzido em 2 unidades. Isso ocorre porque a estrutura da partícula alfa é formada por dois nêutrons e dois prótons.
\(\mathbf{{_Z^A}X\to\ _{Z-2}^{A-4}\ Y+ {_2^4}\alpha}\)
O núcleo atômico do urânio-238 emite partículas alfa, transformando-se em tório-234:
\(\mathbf{_{92}^{238}\ U\to\ _{90}^{234} Th+{_2^4}\alpha}\)
-
2ª lei da radioatividade ou lei de Soddy, Fajans e Russel
Quando um núcleo atômico emite uma partícula beta, seu número de massa não se altera e seu número atômico aumenta em 1 unidade, originando um novo núcleo. Esse processo está representado abaixo e é denominado lei de Soddy, Fajans e Russel.
\(\mathbf{{_Z^A}X\to\ _{2+1}^A Y+\ _{-1}^0\beta}\)
O núcleo do césio-137 é um beta emissor. Assim, emite uma partícula beta e forma um novo núcleo atômico, o bário-137:
\(\mathbf{_{55}^{137}Cs\to\_{56}^{137} Ba+\ _{-1}^0\beta}\)
Radioatividade natural
Com a observação dos efeitos da radiação, vieram os estudos e investigações sobre a sua origem. Os estudiosos entenderam que a radiação é um fenômeno natural e que ocorre de forma espontânea em núcleos instáveis.
A estabilidade do núcleo de um átomo depende das forças nucleares fortes entre partículas, que nada mais são do que o equilíbrio entre forças atrativas e repulsivas. A relação entre a quantidade de nêutrons e prótons é um fator importante para a estabilidade nuclear.
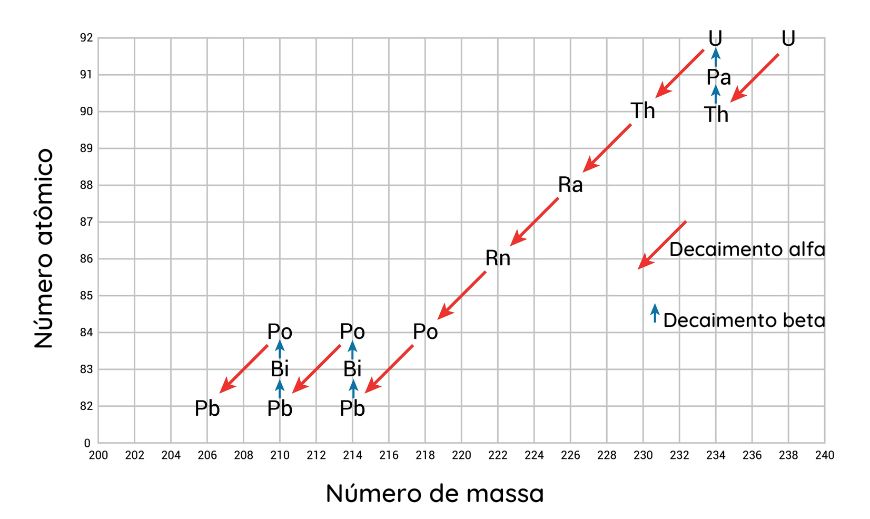
Um núcleo atômico instável se converte em um novo núcleo atômico, mais estável e com menor energia, por meio da emissão radioativa espontânea. Esse processo é denominado transmutação natural ou decaimento radioativo. O termo “decaimento” é empregado porque há redução do número atômico ou do número de massa durante o processo. Algumas vezes, utiliza-se o termo “desintegração” para se referir a esse fenômeno.
O processo de decaimento radioativo pode acontecer sucessivas vezes com um núcleo atômico até que uma configuração nuclear estável seja alcançada. Por exemplo, o urânio-238 passa por 14 processos de decaimento radioativo até formar o chumbo-206 estável.
Elementos radioativos
Elementos radioativos são aqueles que possuem núcleo atômico instável e são passíveis de sofrer decaimento radioativo, transmutando-se em novos núcleos atômicos estáveis, acompanhados de emissão alfa, beta ou gama.
Todos os elementos químicos (e seus isótopos) que possuem número atômico maior ou igual a 84 são instáveis e, portanto, radioativos. O elemento polônio possui Z = 84; assim, os elementos da Tabela Periódica acima do polônio possuem todos os seus isótopos radioativos.
Os elementos químicos de menor número atômico do que o polônio possuem ao menos um isótopo radioativo. Por exemplo, o hidrogênio (Z = 1) possui três isótopos (\({_1^1}H,\ {_1^2}H\ e\ {_1^3}H\)), sendo apenas o hidrogênio-3 radioativo. O carbono (Z = 6) também possui três isótopos (\(_6^{12}C,\ _6^{13}C\ e\ _6^{14}C\)), sendo apenas o carbono-14 radioativo.
Entre os elementos naturais, que são os que ocorrem espontaneamente na natureza, os núcleos radioativos são:
-
polônio – 84Po;
-
radônio – 86Rn;
-
rádio – 88Rd;
-
actínio – 89Ac;
-
tório – 90Th;
-
protactínio – 91Pa;
-
urânio –92U.
Além destes, há outros 28 elementos radioativos que são ditos artificiais, porque foram preparados em laboratório.
Decaimento radioativo
Núcleos atômicos instáveis sofrem o processo de decaimento radioativo para atingir a configuração de estabilidade, sofrendo transmutação para um novo elemento químico.
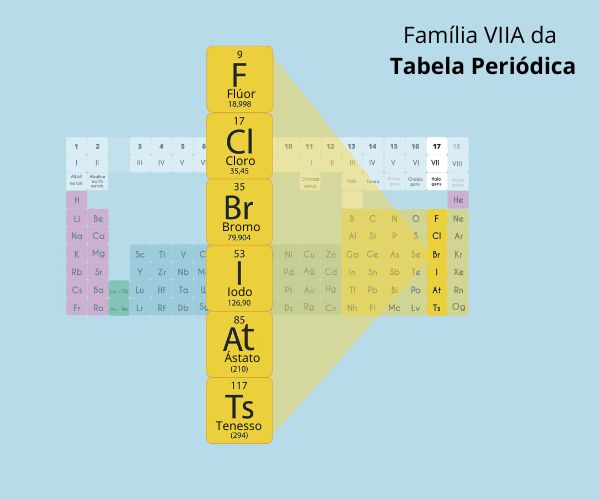
O tempo de desintegração é dado em termos de tempo de meia-vida (t1/2) e é característico para cada tipo de processo e de núcleo atômico.
A meia-vida é o tempo necessário para que metade dos núcleos radioativos se desintegre. Ou seja, corresponde ao tempo necessário para que uma amostra radioativa seja reduzida à sua metade.
O tempo de desintegração é expresso por uma curva de decaimento radioativo, em formato exponencial.
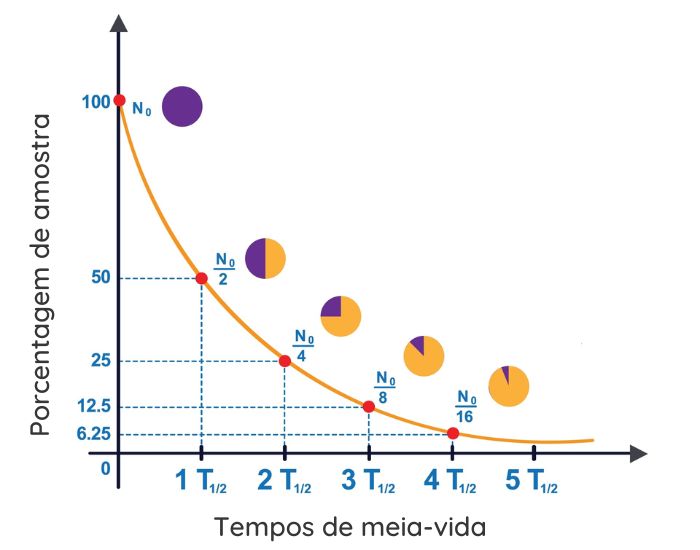
Esse perfil de gráfico indica que a taxa de desintegração do núcleo instável é mais alta inicialmente e vai diminuindo de velocidade conforme sua concentração diminui. No exemplo do gráfico, após o primeiro tempo de meia-vida, a massa do isótopo radioativo cai pela metade. Após o segundo tempo de meia-vida, o valor de massa corresponde a ¼ da massa inicial. Na terceira ocorrência do tempo de meia-vida, a massa totaliza 1/8 da massa inicial e assim sucessivamente.
É por isso que contaminação por material radioativo ou o armazenamento desse tipo de material são muito perigosos, pois dependendo do tempo de meia-vida, pode levar muito tempo até a concentração da espécie ser reduzida a uma quantidade muito pequena e não apresentar mais riscos.
Saiba mais: Meia-vida dos elementos radioativos
Para que serve a radioatividade?
A radioatividade possui importantes aplicações no cotidiano. Com os avanços científicos, foi possível utilizar esses elementos com o máximo de segurança possível.
Nas usinas nucleares, energia elétrica é produzida por meio da energia térmica gerada em reações nucleares, como a fissão e a fusão nuclear. Esse tipo de fonte energética é uma alternativa em países com menor oferta de recursos naturais. Estima-se que 14% da energia elétrica gerada no mundo seja por fontes nucleares. O Brasil possui duas usinas nucleares, localizadas no Rio de Janeiro, as quais são responsáveis pela geração de cerca de 1% da energia elétrica consumida no país.
![Usina nuclear de Angra dos Reis, no Rio de Janeiro. [1]](https://static.manualdaquimica.com/2023/02/usina-angra-reis.jpg)
No setor industrial, os raios gama são usados na esterilização de materiais e utensílios médicos, os quais seriam danificados pela exposição ao calor. A esterilização de alimentos também pode ser feita de forma segura com o uso de raios gama, visando a maior tempo de conservação dos produtos, pela destruição de microrganismos.
A radiação é empregada em algumas análises químicas e laboratoriais, sendo importante para a identificação e quantificação de elementos químicos. Um exemplo é o rastreamento de poluentes, como o mercúrio, no ar, água e solos.
Na medicina, os radioisótopos são usados como agentes de contraste, atuando como marcadores em exames médicos, tornando possível o mapeamento de alterações no organismo, como localização de tumores ou obstruções. Elementos radioativos também são usados em tratamentos médicos, como na radioterapia e angioplastia.
No ambiente doméstico, os detectores de fumaça utilizam uma quantidade, muito baixa, do isótopo amerício-241.
Por outro lado, a radiação também é empregada em aplicações pouco admiráveis, como no desenvolvimento de armas nucleares. Um exemplo disso foram as bombas atômicas lançadas em Hiroshima e Nagasaki, durante a Segunda Guerra Mundial.
Leia também: Química nuclear — área de estudos voltada para os fatores envolvidos no uso da radioatividade
Lixo radioativo
O lixo radioativo é o resíduo que contém elementos radioativos, oriundo de atividades hospitalares, de centros de pesquisa e de usina nucleares. Esse resíduo oferece riscos à saúde de seres vivos e ao equilíbrio do ecossistema, e, por isso, sua destinação é rigidamente regulada.
O destino do lixo radioativo depende de sua composição química e nível de radioatividade, que pode ser alto, médio ou baixo. De modo geral, os resíduos classificados como de médio ou baixo risco são confinados em depósitos subterrâneos, armazenados em recipientes de chumbo, revestidos de concreto.
Os resíduos de elevado risco demandam estratégias mais complexas. É comum seu confinamento em recipientes de aço, chumbo e concreto, os quais ficam submersos em piscinas de resfriamento, também isoladas por camadas de aço, chumbo e concreto.
O tempo de armazenamento desses materiais depende do seu tempo de meia-vida, que pode variar de dezenas a milhares de anos.

Atualmente, uma forma de armazenamento de resíduos radioativos derivados dos produtos de fissão do urânio-235 é a mistura com vidro fundido, a elevadas temperaturas, permitindo a redução do volume de resíduo e facilitando o armazenamento.
Descoberta da radioatividade
Os estudos sobre radioatividade foram iniciados por Wilhelm Conrad Roentgen, em 1895. Roentgen estava trabalhando em laboratório quando notou uma estranha fluorescência vindo de uma mesa próxima. Após uma observação mais detalhada, ele descobriu que se originava de uma ampola de Crookes (tubo de vidro contendo gás rarefeito e dois eletrodos) que estava coberta com papel preto opaco e que, mesmo assim, transmitia luminosidade a uma tela fluorescente.
Roentgen concluiu que a fluorescência desconhecida, que penetrou no papel preto opaco, deve ter sido causada por raios, que mais tarde foram nomeados como raios X (em analogia à incógnita “x” usada em Matemática).
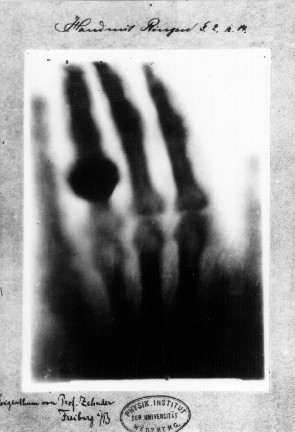
Após testar diversos materiais na presença desses raios, Roentgen percebeu que apenas uma lâmina de chumbo era capaz de bloqueá-los totalmente. Durante os experimentos, observou que a passagem dos raios gerava na tela fluorescente os ossos da sua mão. Então, passou a usar chapas fotográficas para esses registros.
Ao que tudo indica, a imagem abaixo foi a primeira radiografia da história, em que aparece a mão da esposa de Roentgen usando um anel. Roentgen recebeu o Prêmio Nobel de Física em 1901 pela descoberta dos raios X.
Henry Becquerel deu continuidade aos estudos de Roentgen e recebeu o Prêmio Nobel de Física por descobrir a radioatividade, por meio da observação da fluorescência por alguns materiais. Em 1896, Becquerel armazenou diferentes sais e filmes fotográficos, envoltos em papel alumínio e escondidos em uma gaveta. O objetivo era proteger os materiais de qualquer tipo de luminosidade. Após alguns dias, ele desembrulhou as amostras, verificando diferentes contornos dos sais deixados no filme fotográfico.
Pierre e Marie Curie receberam o Prêmio Nobel de Física, em 1903, pelos trabalhos com a radioatividade. Foi Marie Curie quem cunhou o termo “radioatividade”, após a descoberta de Becquerel.
Usando um equipamento que detectava correntes elétricas muito baixas, desenvolvido por Pierre, Marie notou que o urânio eletrificava o ar ao seu redor. Eles também perceberam que a atividade dos compostos de urânio dependia da quantidade presente e comprovaram que a emissão derivava diretamente do elemento (e não da interação com outras moléculas).
Usando os minérios plechbenda e caucolita, o casal Curie descobriu outros elementos radioativos, que justificaram o segundo Prêmio Nobel de Marie Curie pela descoberta do polônio e rádio.

Ernest Rutherford, além de desenvolver um modelo atômico, contribuiu para os estudos da radioatividade. Ele observou que os elementos radioativos sofriam decaimento ao longo do tempo em diferentes tempos. Rutherford empregou partículas alfa para transmutar o oxigênio em nitrogênio, fenômeno denominado à época como “divisão do átomo”.
Exercícios resolvidos sobre radioatividade
Questão 1
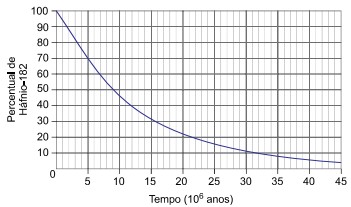
(Vunesp) A chegada do homem à Lua, há 50 anos, possibilitou a coleta das rochas lunares, cuja análise permitiu datar a idade do satélite natural da Terra com maior precisão. A técnica utilizada consistiu em determinar a proporção das quantidades do radioisótopo háfnio-182 e do isótopo estável tungstênio-182 presentes nessas rochas lunares.
O processo de decaimento radioativo do háfnio-182 apresenta uma etapa intermediária, na qual se forma o radioisótopo instável tântalo-182, que, por sua vez, decai para o tungstênio-182, de acordo com a equação:
\(_{72}^{182}Hf \to\ _{73}^{182}Ta+X \to\ _{74}^{182}Ta+X \)
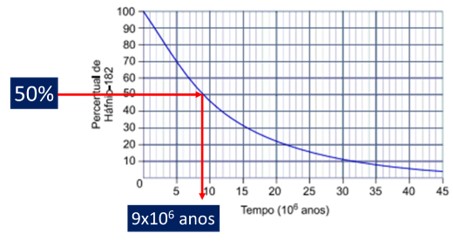
O decaimento radioativo do háfnio-182 resultando no tungstênio-182 em função do tempo ocorre de acordo com a curva apresentada no gráfico.
A emissão radioativa representada pela letra X na equação de decaimento do háfnio-182 e a meia-vida desse radioisótopo em 106 anos são
a) \({_0^1}n\) e 50.
b) \(_{-1}^0\beta\) e 9.
c) \(_0^0\gamma \) e 9.
d) \(_{-1}^0\beta\) e 50.
e) \(_0^1n \) e 9.
Resolução:
Letra B. Analisando a reação de decaimento apresentada, verifica-se que o háfnio e o tálio mantêm números de massa idênticos (= 182) e se diferem pelo número atômico, que aumenta em 1 unidade a cada etapa.
De acordo com a 2ª lei da radioatividade, quando um núcleo atômico emite uma partícula beta, seu número de massa não se altera e seu número atômico aumenta em uma unidade. Portanto, o termo “X” da reação se refere a uma partícula beta.
Pelo gráfico é possível estimar a meia vida do háfnio, sabendo que se refere ao tempo para a concentração inicial ser reduzida à metade. Como o eixo y se refere a porcentagem, 50% do háfnio é obtido em aproximadamente 9×106 anos.
Questão 2
(CEV-Urca) O espintariscópio é um aparelho quase fora de uso, munido de uma tela de sulfeto de zinco utilizado para observar as cintilações produzidas pelo impacto de partículas ionizantes na tela. Sobre as partículas ionizantes, assinale a alternativa correta:
a) As partículas alfa são partículas pesadas de carga elétrica positiva que, ao incidirem sobre o corpo humano, geralmente causam queimaduras de 3º grau.
b) As partículas alfa são leves, com carga elétrica negativa e massa desprezível.
c) A partícula de maior penetração é alfa, porque possui massa igual a 4.
d) Ao emitir radiação γ, um núcleo sofre alteração em sua massa.
e) Quando um núcleo de 235U emite uma partícula alfa, seu número atômico diminui duas unidades, dando o átomo de tório: \(_{92}^{235}U\to _{90}^{231}Th+{_2^4}\alpha\).
Resolução:
Letra E. As partículas alfa possuem carga elétrica positiva, são mais pesadas do que as partículas beta e possuem baixo poder de penetrabilidade, por isso não causam queimaduras na pela humana. Logo, os itens a, b e c são incorretos.
A radiação gama é onda eletromagnética (e não partícula), portanto não possui massa. Dessa forma, em um decaimento radioativo não há alteração de massa em razão da emissão de raios gama. Item d incorreto.
A partícula alfa possui dois prótons e dois nêutrons. Assim, o urânio-235 (Z = 92), ao emitir a partícula alfa, perde dois prótons, transmutando-se em um elemento químico com número atômico 90, que é o tório.
Créditos da imagem
[1] Adriano Aguina / Shutterstock