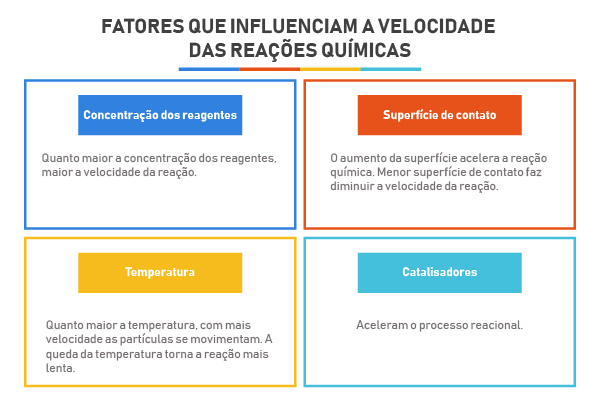
Teoria da Colisão
A Teoria da Colisão especifica como devem ocorrer os choques entre as moléculas dos reagentes para que a reação se processe com maior velocidade.
Por Diogo Lopes Dias

PUBLICIDADE
Um dos fatores que influenciam a velocidade com que uma reação química processa-se é o contato entre os seus reagentes. Se eles não entram em contato uns com os outros, a reação não acontece. Sendo assim, esse é um fator determinante para a ocorrência e a velocidade de uma reação.
O contato entre os reagentes favorece que as moléculas encontrem-se umas com as outras, havendo colisão entre si (choque entre moléculas), o que promove a formação do complexo ativado e, consequentemente, dos produtos da reação. Os choques entre as moléculas devem ocorrer com uma energia mínima para que o complexo ativado seja formado, a chamada energia de ativação. A teoria que explica esses choques entre as moléculas dos reagentes é a Teoria da Colisão.
De acordo com a Teoria da Colisão, quando uma molécula de um reagente choca-se com outra molécula, os átomos de ambas entram em contato entre si, formando uma estrutura molecular denominada de complexo ativado. Após a formação desse complexo, as ligações entre alguns de seus átomos são rompidas e os produtos são formados.
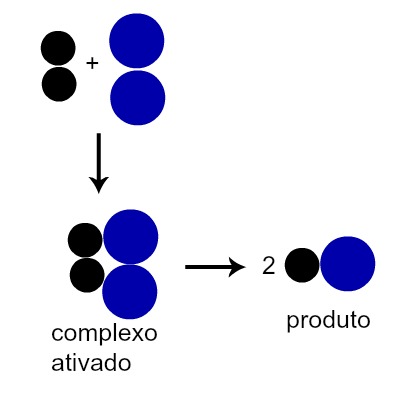
Esquema que representa a formação de um produto após a formação do complexo ativado
A teoria da colisão é proposta quando os reagentes estão no estado gasoso, já que, nesse estado físico, as moléculas apresentam um grau de mobilidade maior. Porém, essa teoria serve de referência para qualquer tipo de reação, estando os reagentes em qualquer estado físico. Ela baseia-se na proposta de ocorrência de dois tipos de colisão, a favorável e a não favorável.
-
Colisão favorável (choque eficaz):
Nesse tipo de colisão, considera-se que todos os átomos de uma molécula chocam-se com todos os átomos de outra molécula. Assim, a formação do complexo ativado e, consequentemente, do produto é mais rápida, ou seja, a colisão favorável favorece que a reação seja processada com uma maior velocidade.
O esquema a seguir representa uma colisão favorável. Podemos observar que cada átomo da molécula diatômica da esquerda encontra-se com cada átomo da molécula diatômica da direita. Assim, temos a formação mais rápida do produto.
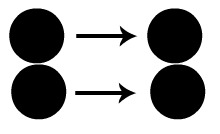
Colisão favorável entre átomos de uma molécula diatômica
-
Colisão não favorável (choque não eficaz)
Nesse tipo de colisão, nem todos os átomo da molécula chocam-se com todos os átomos da outra molécula. Podemos afirmar que os átomos encontram-se de forma gradativa, o que torna a reação mais lenta.
O esquema a seguir representa uma colisão não favorável. Podemos observar que apenas um átomo da molécula da esquerda encontra-se com um átomo da molécula da direita. Os outros átomos só se encontram após o primeiro choque acontecer, o que faz com que a formação do produto ocorra mais lentamente.
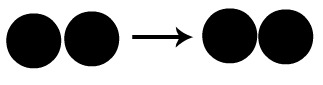
Colisão não favorável entre átomos de uma molécula diatômica
Por Me. Diogo Lopes Dias
Videoaula relacionada: