Introdução à Cinética Química
A cinética química estuda a velocidade das reações e os fatores que a influenciam, bem como a possibilidade de controlá-la, tornando a reação mais rápida ou mais lenta.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
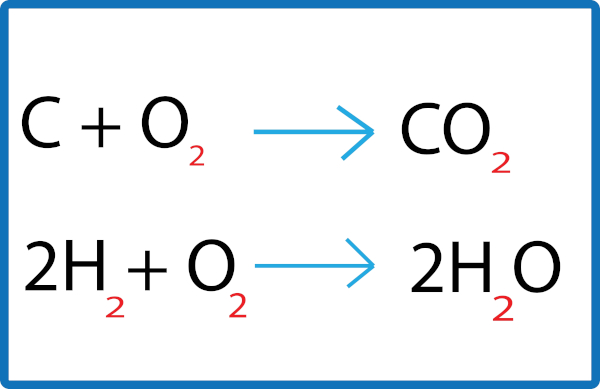
Existem reações em nosso cotidiano que são extremamente rápidas, como a explosão da nitroglicerina. Já outras são muito lentas, como a reação entre o gás hidrogênio e o oxigênio para a formação de água.
Em virtude dessas diferenças de velocidade das reações, podemos expressar o tempo em que elas ocorrem com unidades convenientes em cada caso. Por exemplo, quando falamos do tempo que leva para se formar o petróleo, essa reação é tão lenta que usamos “anos” ou alguns de seus múltiplos, como “século” ou “milênio”. No entanto, para calcular a velocidade da explosão de certa quantidade de pólvora, uma unidade mais apropriada seria “segundos” ou alguns de seus submúltiplos, como o “microssegundo”.
Baseado na velocidade das reações, temos três categorias para elas: rápidas ou instantâneas, moderadas e lentas. Veja alguns exemplos de cada uma:

Exemplos de algumas reações rápidas, moderadas e lentas
É importante estudar as velocidades com que as reações ocorrem para poder interferir nelas quando necessário. Nas indústrias, isso ocorre muito, pois é interessante acelerar reações que ocorrem muito lentamente. Já em outros casos, como em reações que trazem algum dano ao meio ambiente e/ou ao ser humano, é importante retardá-las o máximo possível.
No cotidiano também fazemos isso, quando colocamos alimentos na geladeira para diminuir a velocidade de sua decomposição ou quando colocamos o feijão em uma panela de pressão para aumentar a velocidade de seu cozimento.
O campo que estuda os fatores que influenciam na velocidade das reações químicas e os mecanismos por meio dos quais eles se processam é a Cinética Química.
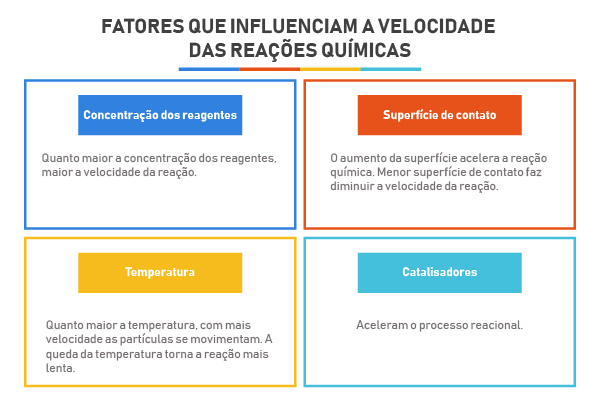
Entre os fatores que influenciam a rapidez com que uma reação se processa, temos:
-
Superfície de contato: Quanto maior a superfície de contato, maior a velocidade da reação;
-
Temperatura: Um aumento na temperatura, geralmente, aumenta a velocidade das reações;
-
Catalisadores: São substâncias químicas capazes de acelerar determinadas reações sem serem consumidas durante o processo;
-
Concentração dos reagentes: Com o aumento da concentração dos reagentes há um aumento no número de choques efetivos entre suas partículas constituintes, o que resulta em um aumento da velocidade da reação.
___________________
* Crédito editorial: Jason and Bonnie Grower / / Shutterstock.com
Por Jennifer Fogaça
Graduada em Química
Aproveite para conferir nossa videoaula relacionada ao assunto: