Energia de ativação
A energia de ativação é um fator determinante para a ocorrência de uma reação química, tendo grande influência ainda na velocidade da reação.
Por Diogo Lopes Dias

PUBLICIDADE
São vários os exemplos de reações químicas que envolvem o cotidiano do ser humano de uma forma geral, o que torna o estudo sobre elas fundamental. Um exemplo de uma reação muito importante pra nós é a combustão da gasolina em veículos automotores, que ocorre de forma a produzir energia suficiente para que o veículo tenha condição de locomover-se.
Uma reação química pode ser processada em velocidades variadas. Enquanto a reação de formação do diamante é extremamente lenta, por exemplo, a explosão de fogos de artifícios ocorre de forma instantânea.
A parte da Química que estuda a velocidade das reações químicas é a Cinética Química, que se volta de forma mais enfática aos mecanismos que determinam e influenciam a velocidade de uma reação química, como a energia de ativação. Todavia, não podemos falar de energia de ativação sem comentar sobre o contato entre os reagentes e as colisões favoráveis.
-
Contato entre os reagentes: Reagentes em contato entre si;
-
Colisões favoráveis: As moléculas dos reagentes devem colidir umas com as outras de forma que o maior número de átomos delas entre em contato.
Segundo a Termoquímica, durante a ocorrência de uma reação, cada reagente apresenta certa quantidade de energia e, além dessa, ele também deve entrar em contato com uma energia proveniente do meio externo.

A faísca é um exemplo de energia de ativação
De uma forma bem objetiva, podemos definir a energia de ativação (Eat) como a energia necessária para a ocorrência de uma reação. Por exemplo, para que a chama do fogão seja formada, é necessário fornecer uma faísca elétrica para permitir a ocorrência da reação entre o gás oxigênio e o gás de cozinha.
A colisão entre as partículas dos reagentes, com orientação favorável e uma energia de ativação suficiente, sempre resulta em um composto denominado complexo ativado. O complexo ativado não é o produto, mas sim um composto intermediário formado entre os reagentes e os produtos. Trata-se de um composto instável que, após ser originado, decompõe-se e forma os produtos. A seguir temos uma representação da formação do complexo ativado do HF a partir da reação entre H2 e F2:
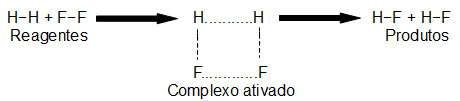
Formação do complexo ativado a partir da reação entre H2 e F2
Observação: Quanto mais o complexo ativado demorar para ser originado, maior será a energia de ativação utilizada pelos reagentes e maior será a velocidade da reação.
É interessante que a energia de ativação não cessa até que o complexo ativado seja formado. Por isso, o complexo ativado é o resultado da energia de ativação máxima. Esse fato pode ser demonstrado por intermédio de um gráfico que relaciona a quantidade de energia e o caminho da reação. Veja um exemplo:
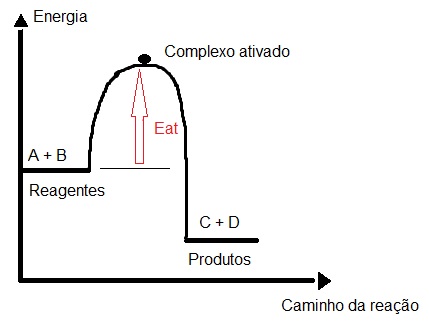
Gráfico que apresenta indicação da energia de ativação
Podemos observar no gráfico uma seta vermelha que parte dos reagentes e vai em direção ao ponto mais alto da curva (complexo ativado). Essa seta representa o complexo ativado. Em um gráfico com valores, podemos determinar o valor da energia de ativação, como no gráfico a seguir:
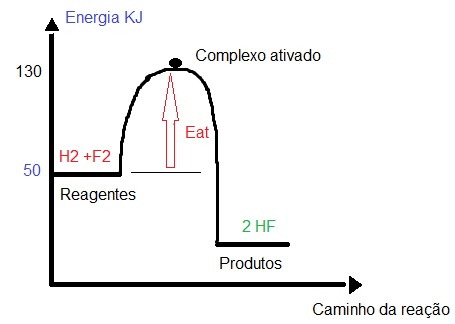
Gráfico que apresenta os valores da energia dos reagentes e o complexo ativado
No gráfico acima, podemos observar que a energia dos reagentes tem um valor de 50 KJ, enquanto a energia do complexo ativado é de 130 KJ. Assim, para determinar o valor da energia de ativação, basta subtrair a energia do complexo ativado pela energia dos reagentes (lembrando que a energia dos reagentes é a que está descrita no eixo y, independentemente do número de reagentes existentes na reação). Veja o exemplo:
Eat = 130 – 50
Eat = 80 KJ
Observação: as reações químicas mais rápidas são aquelas em que a energia de ativação utilizada pelos reagentes é menor, o que resulta em uma formação mais rápida do complexo ativado. Assim, é interessante sempre ter os gráficos das reações que esteja analisando para compará-las.
Comparando o gráfico abaixo com o anterior, podemos perceber que o apresentado logo a seguir indica uma reação química mais rápida que a do outro, pois sua energia de ativação é de 30 KJ.
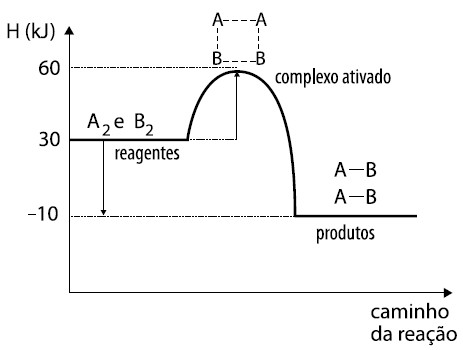
Energia de ativação de uma reação genérica (Gráfico retirado de um exercício da UEL)
Aproveite para conferir a nossa videoaula relacionada ao assunto: