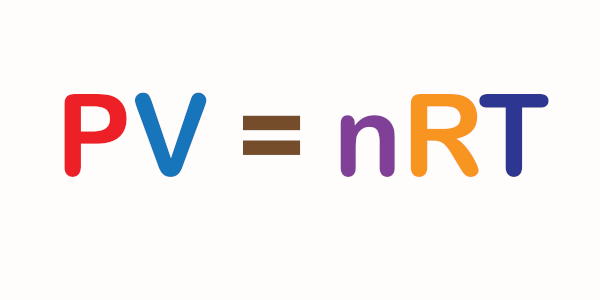Difusão e efusão dos gases
A difusão e a efusão são movimentos desenvolvidos pelas partículas de gases presentes em uma mistura.
Por Diogo Lopes Dias

PUBLICIDADE
Difusão e efusão dos gases são fenômenos relacionados com a movimentação das partículas dos gases presentes em uma mistura. Essa movimentação está diretamente ligada à energia cinética dessas partículas.
Denomina-se de difusão o processo que ocorre quando as partículas de um gás espalham-se de forma uniforme em meio às partículas de outros gases que formam uma mistura gasosa, dentro de um recipiente.
Denomina-se de efusão o movimento das partículas de um gás no sentido de atravessar os orifícios das paredes desse recipiente, ou seja, trata-se do movimento de saída do gás pelas paredes do objeto que o contém.
Representação da difusão:
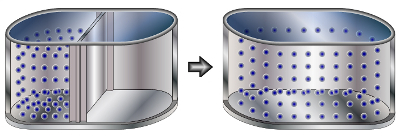
Representação das partículas gasosas em difusão
Na imagem, podemos observar que, quando a divisória é retirada, as partículas gasosas espalham-se por todo o espaço existente. Esse fato caracteriza o fenômeno da difusão. Outro exemplo de difusão é quando borrifamos um perfume em um ambiente.
Representação da efusão:
.jpg)
Representação das partículas gasosas em efusão
Na imagem, podemos observar que existe um orifício no centro do recipiente, e as partículas gasosas tentam passar por esse orifício. Esse fato caracteriza o fenômeno da efusão. Outro exemplo de efusão é quando enchemos um balão em um dia e, no dia seguinte, ele está murcho.
Lei de Graham
Em 1829, o químico inglês Thomas Graham, a partir dos seus estudos sobre difusão e efusão dos gases, estabeleceu a seguinte lei:
“Quando dois gases estiverem nas mesmas condições de temperatura e pressão, suas velocidades de difusão e efusão serão sempre inversamente proporcionais à raiz quadrada de suas densidades ou massas molares.’’

Mistura formada pelos gases A (amarelo) e B (vermelho) em um recipiente
De acordo com a lei de Graham, se temos uma mistura gasosa formada por gases (A e B), a velocidade em que eles sofrem difusão ou efusão (vA e Vb) é inversamente proporcional à raiz quadrada de suas densidades (dA e dB) ou inversamente proporcional à raiz quadrada de suas massas molares (MA e MB).
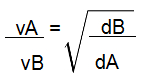
Fórmula da lei de Graham relacionada com a densidade
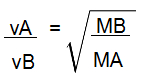
Fórmula da lei de Graham relacionada com a massa molar
Veja um exemplo de aplicação da lei de Graham:
(Mack-SP) A velocidade de difusão do gás hidrogênio (MH2 = 2g/mol) é igual a 27 km/min, em determinadas condições de pressão e temperatura. Nas mesmas condições, a velocidade de difusão do gás oxigênio (MO2 = 32 g/mol), em km/h, é de:
a) 4 km/h
b) 108 km/h
c) 240 km/h
d) 405 km/h
e) 960 km/h
Os dados fornecidos pelo exercício foram:
MH2 = 2g/mol
MO2 = 32g/mol
vH2 = 27 km/min
vO2 = em km/h ?
Como o exercício forneceu uma velocidade de 27 km/min e pede outra em km/h, devemos fazer a adaptação dessa unidade por meio de uma regra de três:
1 min----------27 km
60 min----------x
x.1 = 60.27
x = 1620 km/h
OBS.: 60 minutos corresponde à 1 h.
Por fim, já que no enunciado foram fornecidas as massas molares, vamos utilizar a fórmula da lei de Grahan relacionada às massas molares:
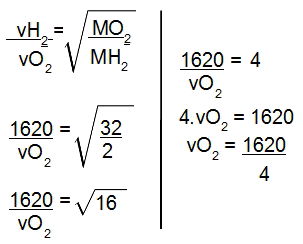
Cálculo da velocidade de difusão do oxigênio
Por Me. Diogo Lopes Dias