Variáveis de estado dos gases
As variáveis de estado dos gases são: pressão, volume e temperatura.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
Quando estudamos um gás, temos que estudar suas três grandezas fundamentais: pressão, volume e temperatura. Essas grandezas são chamadas de variáveis de estado dos gases porque elas influenciam grandemente suas propriedades e comportamento. Por exemplo, só faz sentido mencionarmos o volume do gás se fornecermos também qual é a sua pressão e temperatura.
Vejamos cada uma dessas três variáveis de estado:
-
Pressão:
A pressão é definida como a força exercida na direção perpendicular sobre uma dada superfície em relação à área dela. No caso dos gases, a pressão exercida é provocada pelos choques de suas partículas contra as paredes do recipiente.
A primeira pressão de um gás a ser determinada experimentalmente foi a pressão do ar atmosférico, que, na verdade, é uma mistura de gases. A pressão atmosférica foi obtida pela primeira vez em 1643 pelo cientista italiano Evangelista Torricelli (1608-1647) por meio de seu barômetro de mercúrio.
Ele preencheu um tubo de vidro de 1 metro com mercúrio e o emborcou sobre um recipiente que também continha mercúrio (Hg). A coluna de mercúrio do tubo desceu até parar em determinada altura. Torricelli verificou que ao nível do mar o nível do mercúrio no interior do tubo se estabilizava em 76 cm ou 760 mm. Por isso, o valor da pressão atmosférica ao nível do mar ficou sendo de 760 mm Hg.
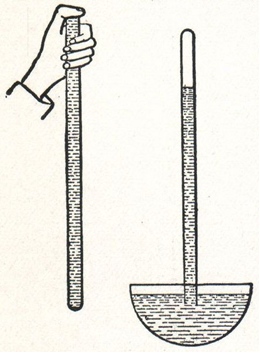
Experimento de Torricelli com tubo de mercúrio para determinar a pressão atmosférica.
Atualmente, a unidade do SI para pressão é o Pascal (Pa = N/m2), mas ainda existem outras que são muito usadas, como o atm e o torr. Veja abaixo a relação entre essas unidades:
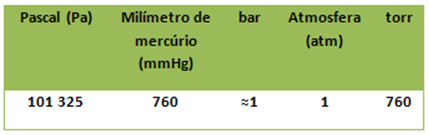
Tabela de equivalências entre as unidades de pressão
Ao nível do mar, temos uma espessura de cerca de 800 km de ar, exercendo essa pressão sobre os corpos. Mas o valor da pressão atmosférica varia com a altitude, pois à medida que vamos para lugares mais elevados que o nível do mar, a pressão atmosférica vai diminuindo e vice-versa.
Abaixo temos a imagem de um barômetro usado atualmente para medir a pressão do ar atmosférico:

Barômetro usado para medir a pressão do ar atmosférico
-
Volume:
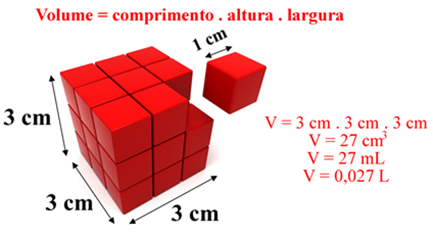
O volume é dado pela multiplicação do comprimento pela altura e pela largura de um corpo, conforme mostrado no caso do cubo abaixo:
No caso dos gases, eles tendem a ocupar o volume do recipiente que os contém, em virtude da sua grande capacidade de expansão.
A unidade de volume no SI é o metro cúbico (m3), mas a mais usada em Química costuma ser o litro (L). Veja algumas relações entre várias unidades usadas para volume:

Tabela de equivalências entre as unidades de volume
-
Temperatura:
A temperatura dos gases mede a agitação de suas moléculas. Quanto maior a velocidade delas, maior a temperatura. O aparelho usado para medir a temperatura é o termômetro, geralmente o de mercúrio, que possui uma graduação com escalas termométricas no tubo de vidro na parte exterior e, por dentro, o mercúrio líquido. Quando a temperatura aumenta, esse líquido se dilata e indica a medida da temperatura.
A unidade no SI é o Kelvin (k), também chamada de escala absoluta. Porém, no Brasil, a mais usada é o graus Celsius (ºC) e, em outros países, usa-se a escala Fahrenheit (°F).
0°C equivale a 273 K, e 373K corresponde a 100°C. Isto significa que para se converter o grau Celsius em Kelvin, basta somar 273: TK = T°C + 273.
Abaixo temos a imagem de um termômetro que possui duas escalas termométricas, a escala Celsius (°C) e a escala Fahrenheit (°F):

Termômetro de mercúrio com escala Celsius e a escala Fahrenheit
Por Jennifer Fogaça
Graduada em Química