Equação de Clapeyron
A equação de Clapeyron é uma combinação matemática de observações experimentais acerca dos estados de um gás.
Por Stéfano Araújo Novais
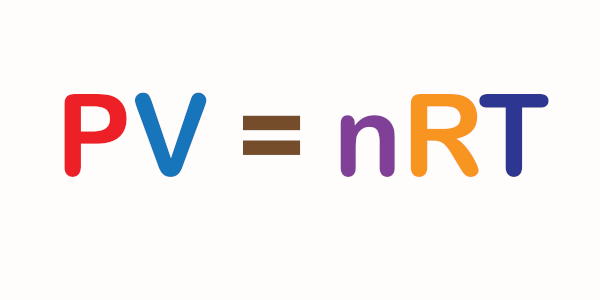
PUBLICIDADE
A equação de Clapeyron, também conhecida como equação (ou lei) dos gases ideais (ou gases perfeitos), é uma combinação matemática de três observações experimentais realizadas acerca do comportamento de um gás ideal, a lei de Boyle, a lei de Charles e o princípio de Avogadro. A equação de Clapeyron pode ser descrita como PV = nRT.
A equação de Clapeyron apresenta a interrelação entre os estados de um gás, como a pressão, o volume, o número de mols e a temperatura. Pode ser aplicada não só para verificar como essas variáveis se alteram por meio das mudanças de condições experimentais, bem como para calcular parâmetros importantes da substância, como a densidade. Embora os gases ideais não existam na realidade, a equação de Clapeyron apresenta boa resposta para gases reais em condições ambiente e, por isso, é amplamente usada.
Leia também: Estudos das variáveis de estado dos gases
Resumo sobre a equação de Clapeyron
- A equação de Clapeyron é a combinação matemática de observações experimentais acerca do comportamento de um gás ideal.
- Sua expressão matemática é PV = nRT.
- A equação de Clapeyron demonstra como os estados de um gás se relacionam entre si em diversas condições experimentais.
- A equação de Clapeyron pode ser aplicada na determinação de propriedades importantes da substância, como a densidade.
- Embora os gases ideais não existam, os gases reais podem apresentar comportamento de gás ideal sob algumas condições específicas.
- Além disso, sabe-se que a equação de Clapeyron apresenta boas respostas experimentais em condições mais próximas da realidade.
Videoaula sobre a equação de Clapeyron
O que é a equação de Clapeyron?
Também conhecida como equação (ou lei) dos gases ideais (ou dos gases perfeitos), a equação de Clapeyron combina três observações experimentais acerca do comportamento de um gás perfeito (as moléculas estão muito afastadas, de modo que a interação entre elas, além de ser igual, é também nula).
Essas três observações experimentais são:
- Lei de Boyle: pV = constante, se n e T são constantes.
- Lei de Charles: V = constante ∙ T, se n e p são constantes; p = constante ∙ T, se n e V são constantes.
- Princípio de Avogadro: V = constante ∙ n, se p e T são constantes.
Em que “p” é a pressão, V é o volume, “n” é o número de mols, e T é a temperatura.
A unificação dessas observações nos leva à seguinte equação, inicialmente descrita por Émile Clapeyron, em 1834 (daí o nome da equação em sua homenagem):
pV = constante ∙ RT
O que diz a equação de Clapeyron?
Com base na equação:
pV = constante ∙ RT
É possível definir, em condições fixas de temperatura, pressão e volume (como nas CNTP, em que T = 273 K, “p” = 1 atm, e 1 mol do gás apresenta V = 22,4 L), a chamada constante universal dos gases ideais (ou constante de Regnault), representada pela letra R. Assim, a equação de Clapeyron fica da seguinte forma:
pV = nRT
O valor de R muda de acordo com as unidades de medição de pressão e volume. A tabela a seguir traz alguns valores possíveis para essa constante.
|
Constante universal dos gases ideais ou constante de Regnault (R) |
8,31446 J K−1 mol−1 (unidade do SI) |
|
8,31446 Pa m³ K−1 mol−1 |
|
|
8,31446 ∙ 10−2 bar L K−1 mol−1 |
|
|
8,20574 ∙ 10−2 atm L K−1 mol−1 |
|
|
62,3636 mmHg L K−1 mol−1 |
|
|
1,98721 cal K−1 mol−1 |
|
|
62,364 L Torr K−1 mol−1 |
Ao se observar as unidades de medida, embora a pressão e o volume possam variar de unidades, a temperatura deve ser sempre utilizada em Kelvin, pois essa escala não admite valores negativos.
Leia também: Tipos de transformações dos gases
Para que serve a equação de Clapeyron?
A equação de Clapeyron é uma equação de estado, ou seja, mostra como a pressão de uma substância (que, neste caso, é um gás) relaciona-se com a temperatura, o volume e a quantidade de matéria (em mols) na amostra.
Embora não existam, na prática, gases ideais, todos os gases reais obedecem à equação de Clapeyron com uma precisão crescente à medida que a pressão do sistema é reduzida até chegar a zero (ou seja, quando P → 0). Embora ela tenha essa limitação (sendo, portanto, conhecida como lei-limite), é percebido que a lei dos gases ideais é razoavelmente correta em pressões normais. Portanto, é possível utilizá-la para descrever o comportamento de diversos gases em condições mais próximas da realidade.
Além disso, a equação de Clapeyron pode ser aplicada em algumas situações. Por exemplo, quando queremos prever o resultado da alteração de mais de uma variável de uma quantidade de gás, na chamada “transformação dos estados de um gás”.
Sabemos que R = PV/nT. Se um gás variar sua pressão de P1 para P2, seu volume de V1 para V2, sua quantidade de matéria de n1 para n2 e sua temperatura de T1 para T2, podemos escrever os estados desse gás, nas condições 1 e 2, em função de R, de modo que:
R = P1V1/n1T1, assim como R = P2V2/n2T2
Logo, podemos dizer que:
P1V1/n1T1 = P2V2/n2T2
Também é possível aplicar a equação de Clapeyron no cálculo da densidade dos gases. Sabemos que d = massa/Volume (ou d = m/V); porém o número de mols de uma substância pode ser calculado pela seguinte expressão:
n = massa/massa molar ou n = m/MM
Pela equação de Clapeyron, podemos substituir n:
\(PV=nRT\)
\(PV = \frac{m}{MM} RT \)
Mas, como a densidade é o valor da massa dividido pelo volume, é possível reajustar a expressão da seguinte maneira:
\(\text{densidade} = \frac{m}{V} = \frac{P \times MM}{R \times T} \)
Equação de Clapeyron no Enem
Segundo a Matriz de Referência do Enem, nos objetos de conhecimento associados à Ciências da Natureza e suas Tecnologias, a equação de Clapeyron está dentro do tópico Transformações Químicas, mais especificamente:
Transformações Químicas - Evidências de transformações químicas. Interpretando transformações químicas. Sistemas Gasosos: Lei dos gases. Equação geral dos gases ideais, Princípio de Avogadro, conceito de molécula; massa molar, volume molar dos gases. Teoria cinética dos gases. Misturas gasosas. Modelo corpuscular da matéria. Modelo atômico de Dalton. Natureza elétrica da matéria: Modelo Atômico de Thomson, Rutherford, Rutherford-Bohr. Átomos e sua estrutura. Número atômico, número de massa, isótopos, massa atômica. Elementos químicos e Tabela Periódica. Reações químicas.
Portanto, questões envolvendo a equação de Clapeyron são possíveis de serem avaliadas dentro do Exame Nacional do Ensino Médio.
Leia também: Como estudar Química para o Enem
Exercícios resolvidos sobre equação de Clapeyron
Questão 1. (Enem/2023) De acordo com a Constituição Federal, é competência dos municípios o gerenciamento dos serviços de limpeza e coleta dos resíduos urbanos (lixo). No entanto, há relatos de que parte desse lixo acaba sendo incinerado, liberando substâncias tóxicas para o ambiente e causando acidentes por explosões, principalmente quando ocorre a incineração de frascos de aerossóis (por exemplo: desodorantes, inseticidas e repelentes). A temperatura elevada provoca a vaporização de todo o conteúdo dentro desse tipo de frasco, aumentando a pressão em seu interior até culminar na explosão da embalagem.
ZVEIBIL V.Z. et al Cartilha de limpeza urbana. Disponível em: www.ibam.org.br. Acesso em: 6 jul 2015 (adaptado).
Suponha um frasco metálico de um aerossol de capacidade igual a 100 mL, contendo 0,1 mol de produtos gasosos à temperatura de 650 °C, no momento da explosão.
Considere: R = 0,082 L∙atm/mol∙K
A pressão, em atm, dentro do frasco, no momento da explosão, é mais próxima de
A) 756.
B) 533.
C) 76.
D) 53.
E) 13.
Resposta: Letra C
Ajustando as unidades de medida em função de R, temos que o volume é de 0,1 L e a temperatura é de 923 K. Aplicando a equação de Clapeyron:
PV = nRT
P ∙ 0,1 = 0,1 ∙ 0,082 ∙ 923
P = 0,082 ∙ 923
P = 75,8 atm ≈ 76 atm
Questão 2. (Enem PPL/2022) Os airbags de segurança dos automóveis são acionados com o impacto, que envia um sinal elétrico para o dispositivo e inicia a reação explosiva do trinitreto de sódio (NaN3), produzindo sódio metálico e nitrogênio molecular, conforme a equação:
2 NaN3 (s) → 2 Na (s) + 3 N2 (g)
O gás produzido tem função de inflar o airbag. Esse tipo de dispositivo contém, aproximadamente, 100 g de NaN3.
Considere: PV = nRT; P = 1 atm; T = 25 °C; R = 0,0821 L · atm/K · mol; 0 °C = 273 K
Massas molares: NaN3 = 65 g/mol; N2 = 28 g/mol; Na = 23 g/mol
Nesse dispositivo, o volume de gás produzido, em litro, é
A) 4,7.
B) 9,4.
C) 18,8.
D) 56,5.
E) 113,0.
Resposta: Letra D.
O volume de gás produzido é determinado pela equação de Clapeyron (PV = nRT). Contudo, não há informações acerca da quantidade de mols de N2 produzida após 100 g de NaN3 serem utilizados para inflar o airbag.
Para tal, faz-se a seguinte estequiometria:
|
2 mols NaN3 |
--------------------------- |
3 mols N2 |
|
100 g NaN3 |
--------------------------- |
x |
Como não se mistura mol e massa de substâncias diferentes e estamos interessados no número de mols de N2, convertemos os 100 g de NaN3 para mols por meio da seguinte expressão:
n = massa/massa molar
n = 100/65
n ≈ 1,54 mol
Com isso, a regra de 3 fica da seguinte forma:
|
2 mols NaN3 |
--------------------------- |
3 mols N2 |
|
1,54 mol NaN3 |
--------------------------- |
x |
Portanto, x = 2,31 mols de N2.
Substituindo-se o valor de mols de N2 na equação de Clapeyron, temos que:
PV = nRT
1 ∙ V = 2,31 ∙ 0,0821 ∙ 298
V ≈ 56,5 L
Fontes
ATKINS, P.; DE PAULA, J.; KEELER, J. Physical Chemistry. 11. ed. Oxford: Oxford University Press, 2018.
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
CASTELLAN, G. Fundamentos de Físico-Química. 1. ed. Barueri: LTC Editora, 1986.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.