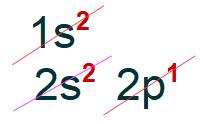Distribuição eletrônica em orbitais
A distribuição eletrônica em orbitais é uma representação dos elétrons presentes em cada orbital de cada subnível pertencente a um nível de um átomo.
Por Diogo Lopes Dias
PUBLICIDADE
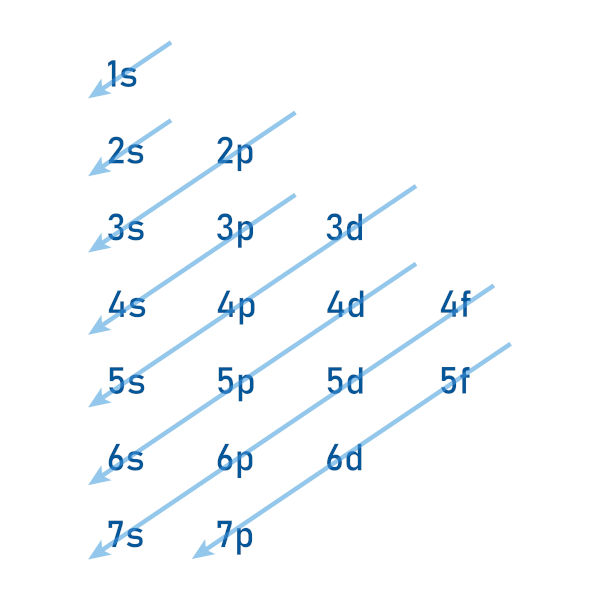
Distribuição eletrônica em orbitais é uma forma diferente de representar a distribuição eletrônica de um átomo. Nela, demonstramos os elétrons dentro dos orbitais de cada subnível (s, p, d, f), em cada um dos níveis (1o, 2o, 3o, 4o, 5o, 6o, 7o).
Veja também: Distribuição eletrônica
Orbitais dos subníveis
-
Subnível s: apresenta apenas 1 orbital, o qual comporta, no máximo, 2 elétrons:
-
Subnível p: apresenta 3 orbitais, que comportam, no máximo, 6 elétrons:
-
Subnível d: apresenta 5 orbitais, que comportam, no máximo, 10 elétrons:
-
Subnível f: apresenta 7 orbitais, que comportam, no máximo, 14 elétrons:
Veja também: Evolução dos modelos atômicos
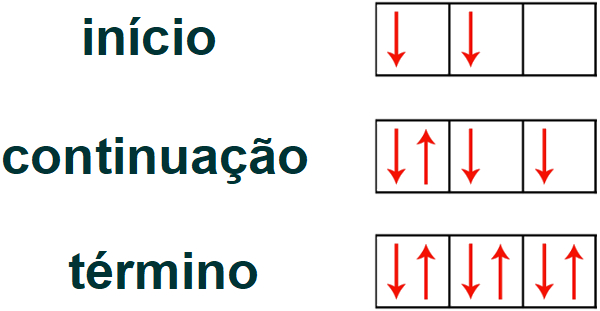
Obs.: o preenchimento dos orbitais segue a regra de Hund, que determina que cada orbital deve ser preenchido, inicialmente, com um elétron (todos no mesmo sentido). Depois que cada orbital tiver um elétron, deve-se voltar ao primeiro orbital e continuar o preenchimento de cada um deles com o segundo elétron (no sentido contrário).
Exemplos de distribuição eletrônica em orbitais
→ Átomo de boro
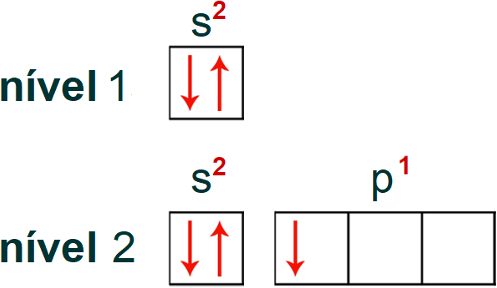
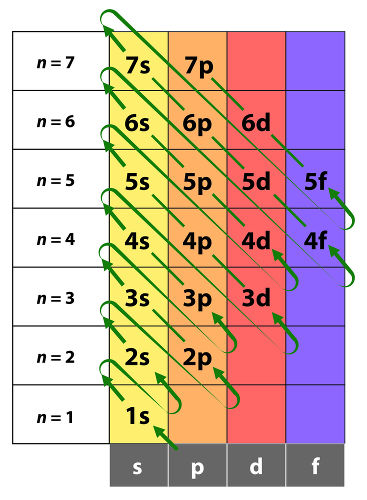
O átomo de boro apresenta número atômico 5, logo apresenta 5 elétrons. Observe a distribuição eletrônica do átomo de boro no diagrama de Linus Pauling:
Sabendo quais são os níveis e subníveis do átomo, bem como a quantidade de elétrons presente em cada um deles, é possível realizar a distribuição eletrônica do boro em orbitais.
Nessa distribuição, teremos um total de 5 orbitais: 1 orbital (referente ao subnível s) no primeiro nível e 4 orbitais (1 referente ao subnível s e 3 ao subnível p) no segundo nível. Observe essa distribuição a seguir:
→ Átomo de cromo
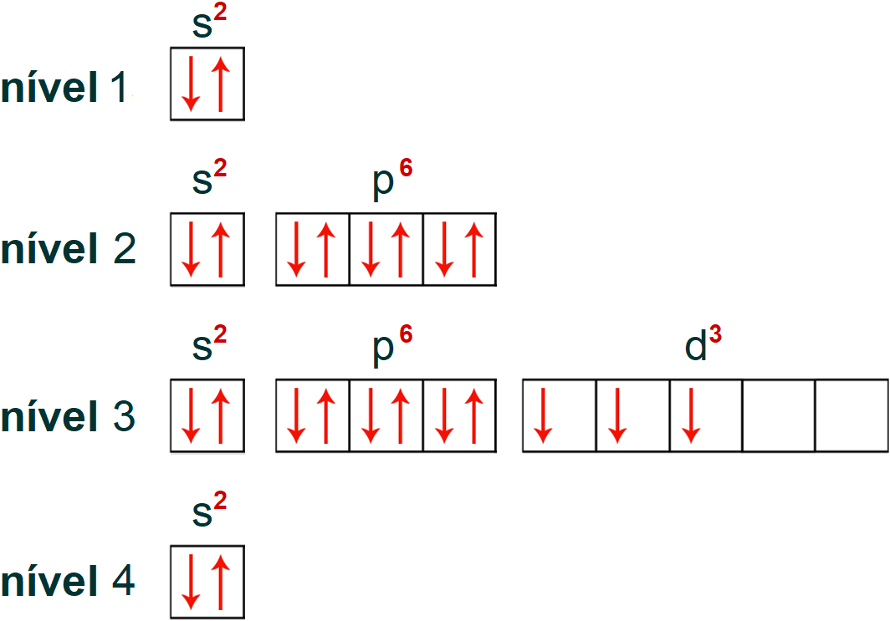
O átomo de cromo apresenta número atômico 23, logo apresenta 23 elétrons. Observe a distribuição eletrônica do átomo de cromo no diagrama de Linus Pauling:
Sabendo quais são os níveis e subníveis do átomo, bem como a quantidade de elétrons presente em cada um deles, é possível realizar a distribuição eletrônica do cromo em orbitais.
Nessa distribuição, teremos um total de 15 orbitais: 1 orbital (referente ao subnível s) no primeiro nível, 4 orbitais (1 referente ao subnível s e 3 ao subnível p) no segundo nível, 9 orbitais (1 referente ao subnível s, 3 ao subnível p e 5 ao subnível d) no terceiro nível e 1 orbital (referente ao subnível s) no quarto nível. Observe essa distribuição a seguir: