Modelo atômico de Rutherford-Bohr
O modelo atômico de Rutherford-Bohr combina a ideia de um núcleo central positivo com a noção de níveis de energia quantizados. Foi proposto por Bohr em 1913.
Por Jhonilson Pereira Gonçalves
PUBLICIDADE
O modelo atômico de Rutherford-Bohr foi proposto por Niels Bohr em 1913 e aprimorou o modelo de Rutherford ao incorporar conceitos da teoria quântica extremamente importantes para explicar fenômenos como a emissão de luz pelos átomos, trazendo uma compreensão de como os elétrons se organizam ao redor do núcleo e como interagem com a energia.
Assim, pela primeira vez, um modelo atômico explicava por que os elementos emitem cores específicas quando aquecidos, como no famoso teste da chama, que você talvez tenha visto em laboratório. Esse modelo é resultado de observações experimentais, questionamentos e da ousadia de unir conceitos da Física clássica com os princípios da Física quântica, que começava a se desenvolver.
Leia também: Evolução dos modelos atômicos em ordem cronológica
Resumo sobre modelo atômico de Rutherford-Bohr
- O modelo atômico de Rutherford-Bohr combina ideias de Rutherford (1911) e Bohr (1913).
- Rutherford propôs o átomo com núcleo central, denso e positivo, com elétrons ao redor.
- Modelo de Rutherford tinha limitações: não explicava a estabilidade atômica nem os espectros de emissão.
- Bohr introduziu conceitos da Física quântica ao modelo de Rutherford.
- Elétrons ocupam órbitas fixas e quantizadas, chamadas de níveis de energia.
- Elétrons só emitem ou absorvem energia ao mudarem de órbita (fótons).
- O modelo explica os espectros de emissão e absorção, sobretudo do hidrogênio.
- A principal diferença entre os dois modelos é que Rutherford seguia a Física clássica, enquanto Bohr integrou princípios da Física quântica.
- Rutherford descobriu o núcleo atômico após experimentos com partículas alfa e lâmina de ouro.
- Bohr aperfeiçoou o modelo com base na teoria quântica e nos espectros atômicos.
- O modelo Rutherford-Bohr marcou a transição para a compreensão moderna do átomo e serviu de base para o modelo quântico atual.
Videoaula sobre modelo atômico de Rutherford-Bohr
O que é o modelo atômico de Rutherford-Bohr?
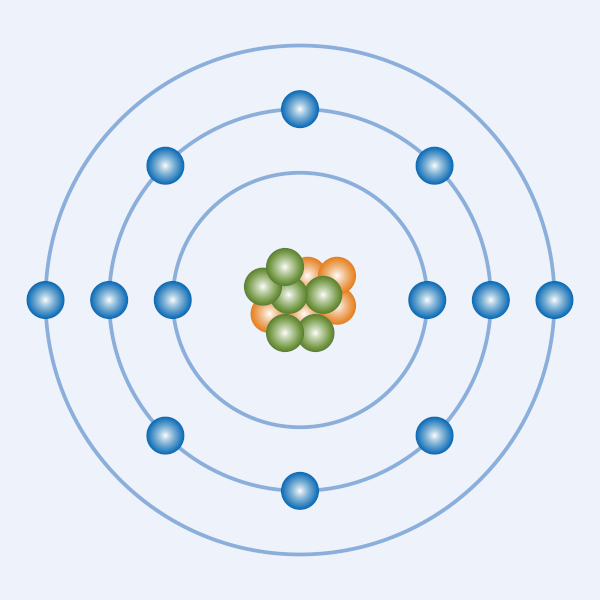
O modelo atômico de Rutherford-Bohr ganha esse nome porque mescla as ideias de Ernest Rutherford e Niels Bohr, sendo proposto por Bohr em 1913. Nesse sentido, Rutherford já havia sugerido que o átomo tem um núcleo central, denso e positivo, ao redor do qual os elétrons giram semelhantemente a planetas em torno do Sol. No entanto, esse modelo apresentava limitações, principalmente ao tentar explicar a estabilidade dos átomos e os espectros de emissão.
Nesse contexto Bohr introduziu correções baseadas em conceitos da Física quântica, pois, segundo ele, os elétrons não giram ao acaso ao redor do núcleo, mas sim em órbitas circulares bem definidas chamadas de “níveis de energia” ou simplesmente “camadas eletrônicas”. Cada uma dessas órbitas tem uma energia específica, e os elétrons podem transitar entre elas, ganhando ou perdendo energia na forma de luz (fótons).
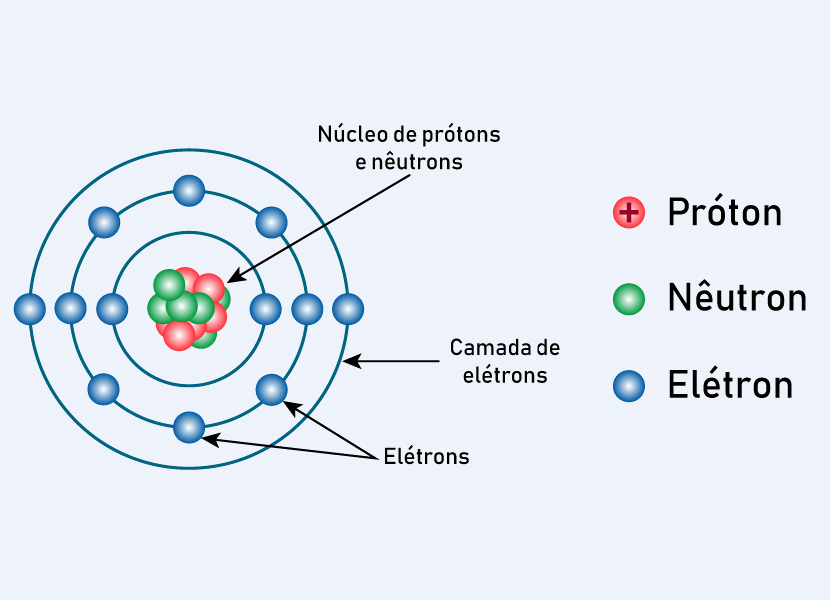
Características do modelo atômico de Rutherford-Bohr
Além da ideia de um núcleo central positivo com elétrons em volta herdada do modelo anterior, as características do modelo atômico de Rutherford-Bohr incluem as complementações realizadas, as quais são:
- Níveis de energia quantizados: níveis em que os elétrons ocupam apenas órbitas específicas e não qualquer posição ao redor do núcleo. Em outras palavras, o elétron não pode estar em qualquer lugar ao redor do núcleo, mas apenas em trajetórias bem definidas.
- Estabilidade do elétron na órbita: o elétron não perde energia enquanto permanece em um nível permitido, o que impede o colapso no núcleo. Isso resolveu o problema do modelo anterior, que previa que o elétron, por estar em movimento, acabaria perdendo energia e colapsando no núcleo, o que não ocorre na realidade.
- Transições de nível: os elétrons podem saltar de um nível para outro, desde que absorvam ou emitam uma quantidade exata de energia na forma de fótons.
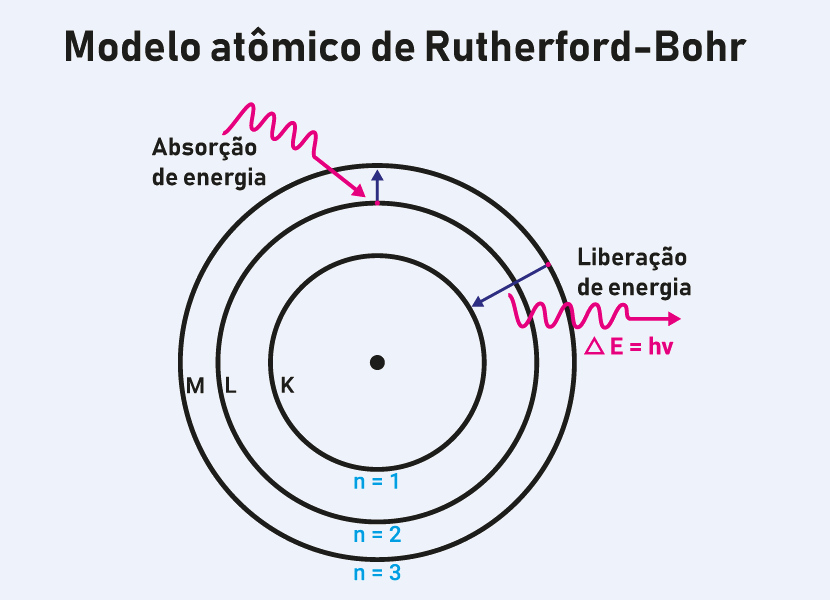
- Explicação dos espectros de emissão e absorção de luz observados experimentalmente, sobretudo no caso do átomo de hidrogênio, graças às transições de um nível para outros realizadas pelos elétrons.
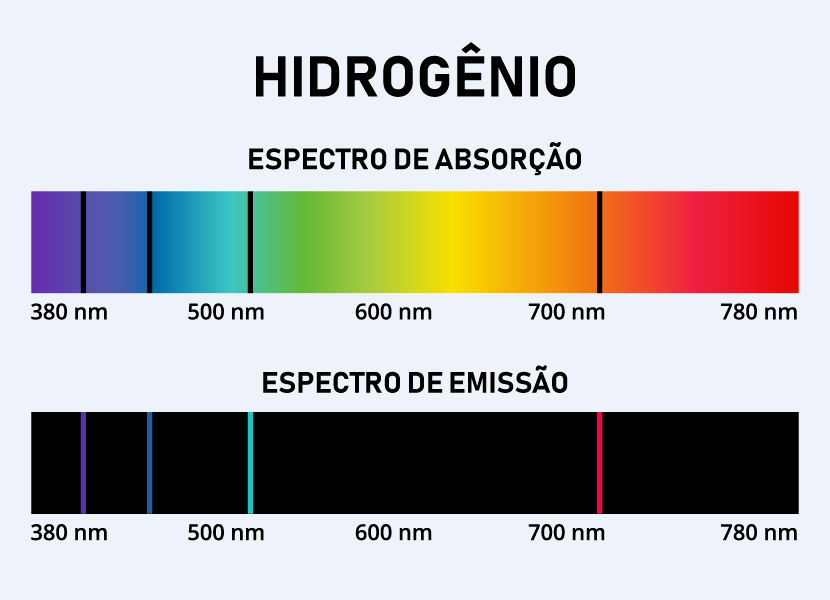
É com base nesses princípios que se torna possível identificar certos elementos metálicos por meio do teste de chama, uma análise qualitativa comum em laboratórios de ensino. Quando aquecidos, os elétrons absorvem energia térmica e saltam para camadas mais externas. Ao retornarem às suas camadas originais, liberam essa energia na forma de luz, com comprimentos de onda característicos para cada elemento, o que explica as cores distintas observadas no experimento, conforme mostra a imagem abaixo.

Diferenças do modelo de Rutherford e de Bohr
Para uma melhor compreensão das diferenças entre o modelo de Rutherford e de Bohr, veja no quadro abaixo a comparação entre eles:
|
Aspecto |
Modelo de Rutherford |
Modelo de Bohr |
|
Estrutura do átomo |
Elétrons giram ao redor do núcleo sem órbitas definidas |
Elétrons giram em órbitas específicas e quantizadas |
|
Energia dos elétrons |
Energia variável e indefinida |
Energia fixa em cada órbita |
|
Estabilidade do átomo |
Não explicava a estabilidade |
Explica a estabilidade por níveis de energia fixos |
|
Explicação dos espectros |
Não explicava os espectros de emissão e absorção |
Explica os espectros por saltos entre níveis de energia |
|
Base teórica |
Física clássica |
Física clássica combinada com conceitos da Física quântica |
Diante disso, podemos destacar que uma das principais diferenças está no fato de que o modelo de Rutherford não explicava por que os elétrons não perdiam energia e colapsavam no núcleo, como previsto pelas leis do eletromagnetismo clássico. Outra distinção relevante é que o modelo de Bohr explica os espectros de emissão e absorção de forma precisa, enquanto o modelo de Rutherford não contemplava esse comportamento.
Veja também: Quais são os princípios da distribuição eletrônica?
Quem foram Rutherford e Bohr?
Ernest Rutherford e Niels Bohr foram dois cientistas importantes para o avanço da teoria atômica no início do século XX, uma vez que cada um contribuiu com ideias que transformaram a maneira como a estrutura do átomo é compreendida. Enquanto o primeiro foi quem identificou a existência do núcleo atômico, o segundo deu um passo além ao quantizar o comportamento dos elétrons, unindo as descobertas experimentais com os princípios da mecânica quântica.

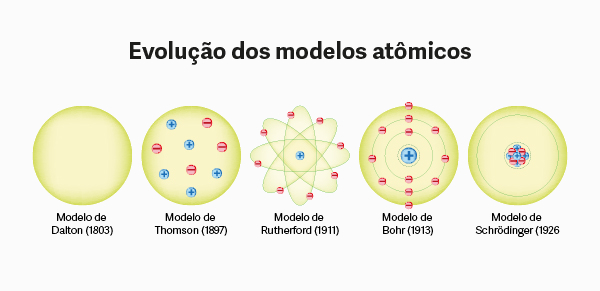
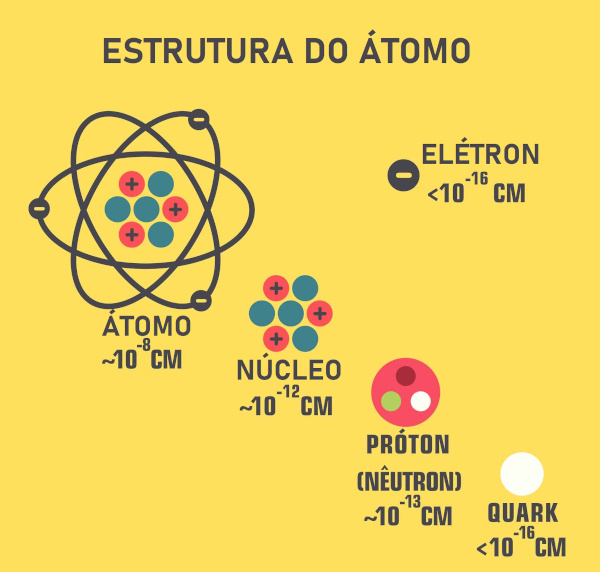
Rutherford foi um físico neozelandês considerado o pai da Física nuclear, porquanto, em 1911, propôs um modelo atômico com base em seus experimentos com partículas alfa e folhas de ouro. Com base nesses resultados, concluiu que o átomo não era uma massa positiva com elétrons embutidos, como sugerido por Thomson, mas sim uma estrutura com um núcleo central pequeno, denso e positivo, ao redor do qual os elétrons orbitam. Sua proposta revolucionou nossa compreensão acerca do átomo, pois introduziu o conceito de núcleo atômico.
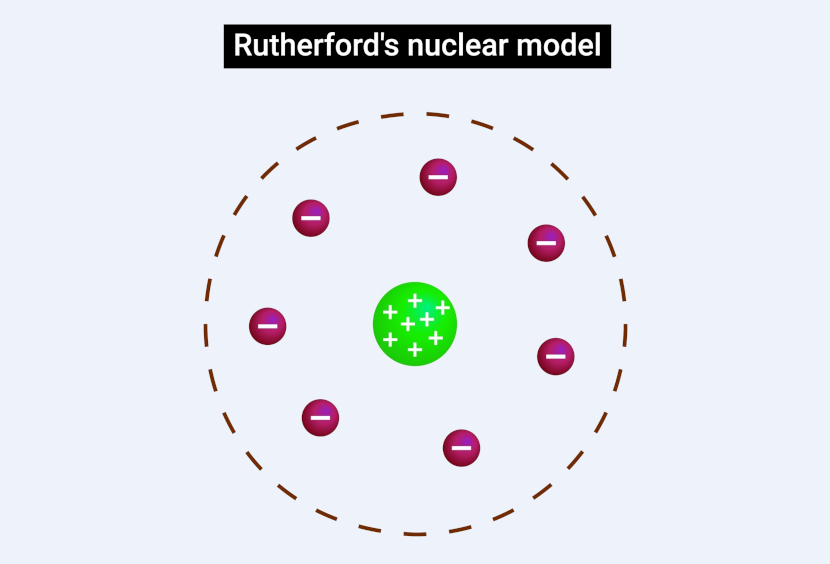
Já Niels Bohr foi um físico dinamarquês que aprofundou esse modelo em 1913 ao incorporar ideias da recém-nascida Física quântica. Com base nos estudos sobre espectros atômicos, Bohr sugeriu que os elétrons giram ao redor do núcleo em órbitas circulares específicas, cada uma com energia bem definida. Introduziu também a ideia de que os elétrons só podem ganhar ou perder energia ao mudar de órbita, emitindo ou absorvendo luz.
História do modelo atômico de Rutherford-Bohr
A história do modelo atômico de Rutherford-Bohr está diretamente ligada ao avanço do conhecimento científico sobre a estrutura da matéria no início do século XX, pois, até então, o modelo mais aceito era o de Thomson, que descrevia o átomo como uma esfera positiva com elétrons incrustados, o chamado modelo do “pudim de passas”. Entretanto, esse modelo foi posto em xeque pelos experimentos realizados por Ernest Rutherford, entre 1909 e 1911.
Utilizando partículas alfa e uma fina lâmina de ouro, Rutherford observou que a maioria dessas partículas atravessava a lâmina, mas algumas eram desviadas e outras até refletidas. Esse resultado inesperado o levou a propor que o átomo possuía um núcleo central, pequeno, denso e positivo, em que se concentra quase toda a massa. Em vista disso, ao redor desse núcleo, os elétrons giravam em órbitas como os planetas ao redor do Sol. Essa proposta ficou conhecida como modelo nuclear do átomo.
Contudo, o modelo de Rutherford apresentava limitações, sobretudo ao tentar explicar a estabilidade do átomo e os espectros de emissão dos elementos. Foi nesse contexto que, em 1913, Niels Bohr propôs modificações com base em princípios da Física quântica e introduziu a ideia de que os elétrons ocupam órbitas fixas e quantizadas, sem emitir energia enquanto permanecem nessas órbitas. Apenas quando mudam de nível emitem ou absorvem energia, o que explicou de forma precisa as linhas espectrais do hidrogênio.
Logo, o modelo atômico de Rutherford-Bohr representou a junção de dois grandes avanços: a estrutura nuclear proposta por Rutherford e os níveis de energia quantizados sugeridos por Bohr. Juntos, esses conceitos formaram a base para a compreensão moderna do átomo, servindo como ponto de partida para o desenvolvimento do modelo quântico atual.
Saiba mais: Números quânticos — o que são e para que servem?
Exercícios resolvidos sobre o modelo de Rutherford-Bohr
1. (UEMG) Os modelos atômicos propostos ao longo da História refletem o avanço do conhecimento sobre a estrutura da matéria, desde a ideia inicial de átomos indivisíveis proposto por Dalton, até os modelos mais complexos descritos pela Mecânica Quântica. Entre essas contribuições, destacam-se os modelos de Rutherford e Bohr, que revolucionaram a forma como entendemos o átomo. Rutherford propôs o núcleo atômico denso e positivo, enquanto Bohr introduziu conceitos inovadores relacionados aos níveis de energia. Com base nos avanços apresentados por esses dois modelos, assinale a alternativa que, corretamente, diferencia as principais características entre as propostas de Rutherford e Bohr.
a) O modelo de Rutherford propõe que os elétrons giram em órbitas circulares ao redor do núcleo em níveis de energia específicos, enquanto o de Bohr considera que os elétrons estão distribuídos, aleatoriamente, em torno do núcleo.
b) No modelo de Rutherford, os elétrons não possuem níveis de energia definidos, enquanto no de Bohr, os elétrons orbitam o núcleo em trajetórias específicas com energias quantizadas.
c) O modelo de Rutherford considera que o núcleo é composto por prótons e nêutrons, enquanto o de Bohr descreve o núcleo como formado, exclusivamente, por prótons.
d) O modelo de Rutherford já previa que os elétrons absorvem ou emitem energia ao saltar entre os níveis, enquanto Bohr abandonou essa ideia em favor de órbitas fixas.
Gabarito: B
A principal diferença entre os modelos atômicos de Rutherford e Bohr está no que foi descrito na alternativa “b”; porquanto, no modelo de Rutherford, os elétrons giram ao redor do núcleo de maneira indefinida, sem níveis de energia específicos, o que tornava o átomo instável segundo as leis da Física clássica. Já no modelo de Bohr, os elétrons ocupam órbitas bem definidas, chamadas níveis de energia, e só podem mudar de nível ao absorverem ou emitirem quantidades específicas de energia, garantindo a estabilidade do átomo e explicando os espectros atômicos observados.
2. (UEMG) O teste de chama é uma técnica utilizada para identificar átomos ou cátions presentes em substâncias ou misturas. Por exemplo, quando uma pequena quantidade de cloreto de sódio é levada à chama de um bico de Bunsen, observa-se que a chama inicialmente azul adquire uma coloração laranja. Assim, na queima de fogos de artifício, verificamos várias cores devido aos diferentes sais utilizados na fabricação dos fogos.
Essas cores podem ser explicadas pelo modelo atômico de
a) Bohr.
b) Dalton.
c) Rutherford.
d) Thomson.
Gabarito: A
No teste de chama, a cor observada é explicada pelo modelo de Bohr, pois ele propôs que os elétrons, ao receberem energia, saltam para níveis mais externos e, ao voltarem para níveis mais internos, liberam energia na forma de luz com cores específicas. Essa emissão de luz colorida é justamente o que permite identificar diferentes elementos na chama.
Créditos da imagem
Fontes
KRAGH, H. Niels Bohr between physics and chemistry. Physics Today, [s. l.], v. 66, n. 5, p. 36–41, 2013.
L. BROWN, T. et al. Átomos, moléculas e íons. In: QUÍMICA: A CIÊNCIA CENTRAL. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 42–73.
MUKUNDA, N. The life and work of Niels Bohr - A brief sketch. Resonance, [s. l.], v. 18, n. 10, p. 877–884, 2013.
RAMOS, T. C.; MENDONÇA, P. C. C.; MOZZER, N. B. Argumentação de estudantes na criação e crítica de analogias sobre o Modelo Atômico de Thomson. Ciência & Educação (Bauru), [s. l.], v. 25, n. 3, p. 607–624, 2019.
REIS, M. A evolução dos modelos atômicos. In: QUÍMICA 1. ENSINO MÉDIO. 1aed. São Paulo: Editora Ática, 2013. v. 1, p. 166–180.
TENFEN, D. N.; TENFEN, W. O modelo atômico de Bohr e as suas limitações na interpretação do espectro do átomo de hélio. Caderno Brasileiro de Ensino de Física, [s. l.], v. 34, n. 1, p. 216, 2017.