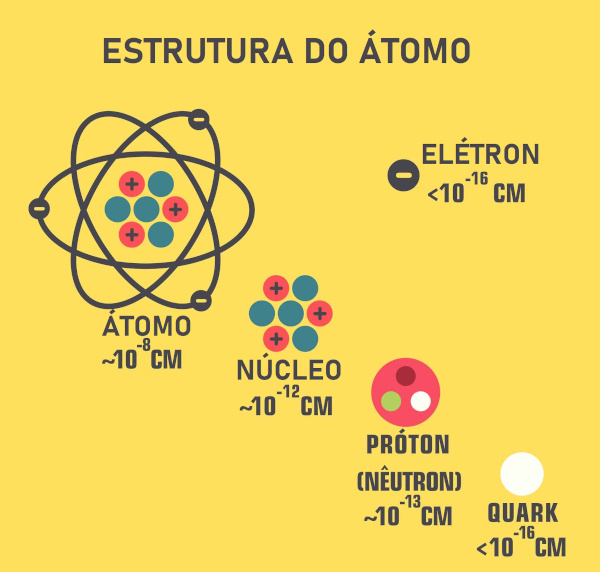
Evolução dos modelos atômicos
A evolução dos modelos atômicos se deu a partir de observações experimentais, originando ideias revolucionárias, propostas por Dalton, Thomson, Rutherford, Bohr e Schrödinger.
Por Everton da Paz Silva
PUBLICIDADE
A evolução dos modelos atômicos segue as ideias apresentadas por Dalton, Thomson, Rutherford, Bohr e Schrödinger, que foram embasadas em observações experimentais e acompanharam o avanço tecnológico da época. Esses modelos representam marcos fundamentais no entendimento da constituição da matéria, influenciando diretamente diversas áreas do conhecimento.
No início do século XIX, John Dalton recuperou o conceito de átomo como a menor unidade da matéria, estabelecendo a ideia de que os elementos químicos são compostos por partículas indivisíveis. Posteriormente, J.J. Thomson revolucionou o conceito ao descobrir a presença de partículas subatômicas carregadas negativamente, os elétrons, introduzindo o modelo conhecido como "pudim de ameixas".
O avanço experimental permitiu que Ernest Rutherford propusesse um modelo baseado em um núcleo denso, positivo, cercado por espaços vazios e uma eletrosfera. Essa concepção foi aprimorada por Niels Bohr, que aplicou princípios da Mecânica Quântica para descrever níveis de energia quantizados, resolvendo questões sobre a estabilidade atômica.
Por fim, o modelo de Schrödinger introduziu uma abordagem teórica baseada em conceitos quânticos avançados, como a dualidade partícula-onda e o princípio da incerteza de Heisenberg. Esse modelo trouxe avanços significativos, especialmente para o estudo de ligações químicas e materiais, impactando a ciência e a tecnologia moderna.
Leia também: Atomística — área da Química dedicada ao estudo do átomo
Resumo sobre a evolução dos modelos atômicos
- A evolução dos modelos atômicos ocorreu com base em observações experimentais, buscando responder a questionamentos centrais sobre a constituição da matéria.
- A ordem cronológica dos modelos é: Dalton (1803), Thomson (1897), Rutherford (1911), Bohr (1913) e Schrödinger (1926).
- Modelo atômico de Dalton (modelo da bola de bilhar): o átomo é uma esfera densa e indivisível. O conjunto de átomos de mesmas propriedades e massas é chamado de elemento químico.
- Modelo atômico de Thomson (modelo do “pudim de ameixas”): o átomo era maciço, formado por uma esfera de carga positiva uniformemente distribuída e com os elétrons incrustados.
- Modelo atômico de Rutherford (modelo nuclear ou planetário): o átomo era formado por um núcleo positivo e espaços vazios na eletrosfera.
- Modelo atômico de Bohr (modelo Rutherford-Bohr): os elétrons giram ao redor do núcleo em órbitas quantizadas, com níveis de energia fixos, podendo sofrer transição eletrônica entre os diferentes níveis ao ganhar ou perder energia na forma de fóton.
- Modelo atômico de Schrödinger (modelo quântico): o elétron se comporta como partícula e como onda, e pode ser localizado em orbitais, regiões do espaço onde há maior probabilidade de encontrar elétrons.
Como foi a evolução dos modelos atômicos?
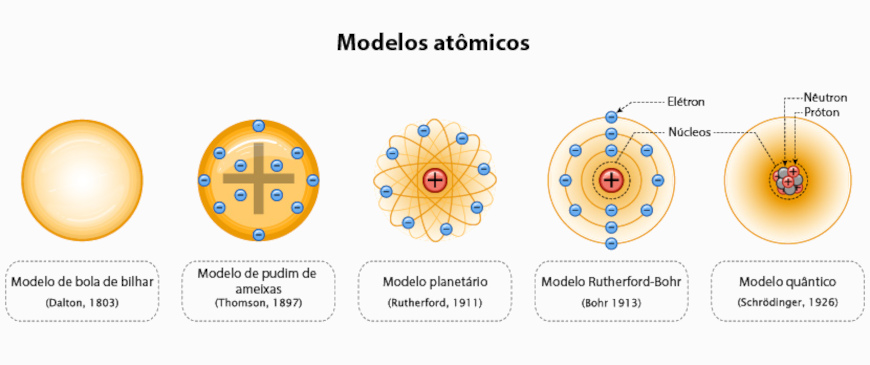
A evolução dos modelos atômicos ocorreu com base em observações experimentais que levaram ao questionamento de ideias centrais sobre a constituição da matéria. Cada nova descoberta científica marcou o rompimento com antigos conceitos e promoveu o desenvolvimento de um pensamento cada vez mais crítico e embasado.
O modelo de Dalton (1803) retomou o conceito do átomo proposto pelos filósofos gregos, como Demócrito, mas rejeitou a antiga ideia de que a matéria era formada pelos quatro elementos fundamentais (terra, água, ar e fogo). Dalton afirmou que a matéria é composta por partículas minúsculas e indivisíveis, os átomos, e que cada elemento químico é formado por átomos de mesma massa e propriedades. Esse modelo trouxe ordem ao estudo dos elementos, abrindo caminho para a lei das proporções múltiplas e o desenvolvimento da tabela periódica.
O modelo de Thomson (1897) rompeu com a ideia de que os átomos eram indivisíveis e homogêneos. Por meio de experimentos com raios catódicos, Thomson identificou partículas subatômicas negativas, os elétrons, propondo o modelo do "pudim de ameixas", onde os elétrons estavam imersos em uma esfera positiva. Essa ideia introduziu o conceito de partículas menores que o átomo, permitindo avanços significativos no campo da eletricidade.
Em 1911, Rutherford seguia tentando compreender melhor o fenômeno recém-descoberto da radioatividade. Através do famoso experimento de dispersão de partículas alfa, revelou que o átomo não era maciço. Ele descobriu que a maior parte da massa e carga positiva do átomo estava concentrada em um pequeno núcleo, enquanto os elétrons orbitavam ao seu redor, deixando vastos espaços vazios. Essa concepção trouxe a ideia de que o átomo tinha uma estrutura interna complexa.
No entanto, o modelo de Rutherford apresentava problemas de instabilidade: de acordo com a Física Clássica, os elétrons deveriam perder energia e colapsar no núcleo. Bohr (1913) resolveu esse problema ao propor que os elétrons ocupam níveis de energia fixos e só emitem ou absorvem energia ao saltar entre esses níveis. Esse modelo foi o primeiro a incorporar conceitos da Mecânica Quântica, sendo fundamental para explicar o espectro de emissão de elementos como o hidrogênio.
Finalmente, o modelo de Schrödinger (1926) abandonou a ideia de órbitas definidas para os elétrons e apresentou o conceito de orbitais, regiões onde há maior probabilidade de encontrar o elétron. Baseado na dualidade partícula-onda e no princípio da incerteza de Heisenberg, esse modelo é inteiramente quântico e permitiu uma compreensão mais precisa das interações atômicas e moleculares.
→ Videoaula sobre os modelos atômicos
Cronologia da evolução dos modelos atômicos
A ordem cronológica dos modelos são: Dalton, Thomson, Rutherford, Bohr e Schrödinger.
- 1803 - Dalton: introduziu a ideia de átomos como blocos fundamentais da matéria. O átomo é uma esfera densa e indivisível.
- 1897 - Thomson: descobriu o elétron e propôs que o átomo era maciço, formado por um esfera de carga positiva uniforme e com elétrons incrustados.
- 1911 - Rutherford: propôs o modelo nuclear, com núcleo positivo e espaços vazios na eletrosfera.
- 1913 - Bohr: desenvolveu o modelo quantizado, onde o elétron gira ao redor do núcleo em órbitas, que são níveis de energia fixos, também chamados de camadas eletrônicas.
- 1926 - Schrödinger: apresentou o modelo quântico, baseado na dualidade da matéria e no princípio da incerteza. Apresenta a ideia de que o elétron ocupa orbitais, regiões de maior probabilidade de o elétron ser encontrado.
Veja também: O que é o número atômico (Z)?
Quais são os modelos atômicos?
Os modelos atômicos são os de Dalton, Thomson, Rutherford, Bohr e Schrödinger. Cada um deles contribuiu significativamente para o entendimento da constituição da matéria.
→ Modelo atômico de Dalton
Em 1803, John Dalton propôs um modelo atômico baseado em experimentos sistemáticos e na análise de propriedades das substâncias químicas. Ele retomou a ideia do átomo como a menor partícula indivisível da matéria, um conceito anteriormente mencionado pelos filósofos gregos Leucipo e Demócrito, mas agora fundamentado em observações experimentais.
A teoria atômica proposta por Dalton é amplamente reconhecida como a base científica da Química Moderna, introduzindo uma compreensão estruturada sobre a constituição da matéria. Dalton utilizou principalmente observações sobre as leis ponderais da Química, como a lei da conservação da massa, de Lavoisier, e a lei das proporções definidas, de Proust, para sustentar suas ideias.
A principal inovação foi a introdução da lei das proporções múltiplas, que estabeleceu que, quando dois elementos formam mais de um composto, a razão entre as massas de um dos elementos que se combina com uma massa fixa do outro está em proporções simples e inteiras. Essa observação fortaleceu a ideia de que a matéria é composta por unidades discretas, os átomos. Dalton imaginava os átomos como partículas esféricas, maciças e indivisíveis, semelhantes a esferas de bilhar, como mostra a imagem a seguir.

Dalton introduziu o conceito de elemento químico, que é o conjunto de átomos que possuem as mesmas propriedades e massas. Por exemplo, o hidrogênio era formado exclusivamente por átomos de hidrogênio, e o oxigênio por átomos de oxigênio, sendo as massas atômicas diferentes entre os elementos. Essa ideia foi revolucionária porque estabeleceu uma conexão entre a massa de um elemento e sua identidade química.
Dalton também introduziu a ideia de que os átomos de diferentes elementos poderiam se combinar em proporções fixas para formar substâncias novas, denominadas compostos químicos, chamadas por ele de átomos compostos. Por exemplo, a água seria composta por átomos de hidrogênio e átomos de oxigênio em proporções fixas.
Embora Dalton não tenha determinado as fórmulas químicas exatas, essa abordagem explicava as reações químicas como rearranjos de átomos e proporcionava uma base para a estequiometria, o cálculo das proporções em reações químicas.
Apesar de sua relevância, o modelo de Dalton apresentava limitações, pois não conseguia explicar fenômenos como a condução elétrica ou a emissão de luz pelas substâncias.
→ Modelo atômico de Thomson
Em 1897, J.J. Thomson apresentou um modelo atômico revolucionário baseado em experimentos com raios catódicos. Ele foi o primeiro a demonstrar que o átomo não era indivisível, como sugerido por Dalton, mas composto por partículas menores. A descoberta do elétron marcou um avanço crucial na compreensão da estrutura da matéria e introduziu o conceito de matéria descontínua.
Os experimentos de Thomson envolveram tubos de raios catódicos, dispositivos que produzem feixes de partículas quando submetidos a uma alta diferença de potencial elétrico. Observando a deflexão desses feixes em campos elétricos e magnéticos, ele concluiu que eram compostos por partículas negativamente carregadas, que chamou de elétrons. Isso desafiou a ideia de que o átomo era uma esfera maciça e indivisível, proposta no modelo de Dalton.
O modelo de Thomson, conhecido como o "modelo do pudim de ameixas", sugeria que o átomo era constituído por uma esfera de carga positiva uniformemente distribuída, na qual os elétrons estavam incrustados, como ameixas em um pudim.
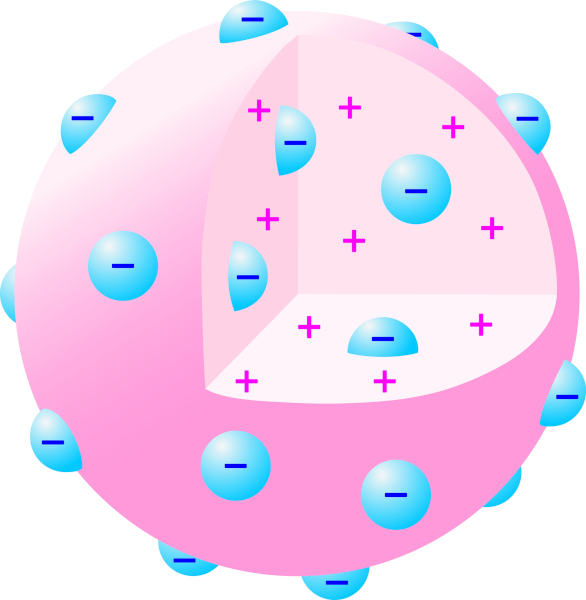
Thomson acreditava que a carga positiva equilibrava a negativa, tornando o átomo eletricamente neutro. A ideia de matéria descontínua surgiu porque o átomo, agora dividido em partículas menores, revelou que as propriedades das substâncias químicas dependiam tanto das partículas positivas quanto das negativas. Essa percepção foi fundamental para o desenvolvimento de conceitos como íons, partículas com carga elétrica, e para o entendimento dos fenômenos elétricos e magnéticos em materiais.
Além disso, Thomson contribuiu para a compreensão do elétron como uma partícula subatômica fundamental, possuindo massa e carga específicas. Ele mediu a razão carga-massa do elétron, abrindo caminho para estudos mais detalhados sobre a estrutura atômica e para a descoberta de outras partículas subatômicas, como o próton e o nêutron.
Thomson imaginava o átomo como uma esfera maciça e, com base nisso, esperava-se que a radiação pudesse atravessar a matéria sem sofrer desvios. Porém, os experimentos conduzidos por Rutherford mostraram o contrário, indicando uma inconsistência com o modelo proposto por Thomson, que não explicava a dispersão de partículas alfa.
→ Modelo atômico de Rutherford
Em 1911, o cientista neozelandês Ernest Rutherford apresentou um modelo atômico revolucionário, resultado de experimentos que desafiavam as concepções anteriores sobre a estrutura do átomo.
A base experimental para esse modelo foi o famoso experimento do bombardeamento da folha de ouro, realizado com a colaboração dos cientistas Hans Geiger e Ernest Marsden. Nesse experimento, partículas alfa (núcleos de hélio carregados positivamente) foram disparadas contra uma fina folha de ouro com o objetivo de observar como elas interagiam com a matéria.
As expectativas iniciais, baseadas no modelo de Thomson, indicavam que as partículas alfa atravessariam a folha de ouro com mínimas deflexões, uma vez que o átomo era considerado uma esfera uniforme de carga positiva onde os elétrons estavam dispersos. No entanto, os resultados foram surpreendentes: a maioria das partículas atravessou a folha sem alterações significativas em sua trajetória. Algumas sofreram desvios, e uma pequena fração foi refletida em ângulos muito grandes, indicando colisões frontais com algo muito denso.
Essas observações levaram Rutherford a propor um novo modelo atômico, no qual o átomo era formado por:
- Um núcleo pequeno, denso e carregado positivamente, onde estava concentrada quase toda a massa do átomo.
- Uma eletrosfera composta por elétrons, que gira em torno do núcleo, ocupando uma vasta região quase vazia.
Esse modelo foi frequentemente comparado a um sistema planetário, em que os elétrons orbitavam o núcleo tal como os planetas giram ao redor do Sol, como mostra a imagem a seguir.
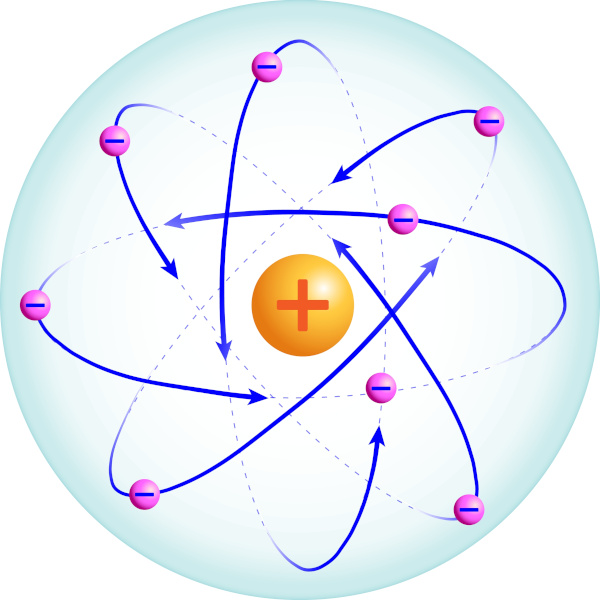
A principal característica dessa estrutura era o enorme espaço vazio entre o núcleo e a eletrosfera, o que explicava o porquê de a maioria das partículas alfa passar pela folha de ouro sem deflexão.
Apesar de seu avanço em relação ao modelo de Thomson, o modelo de Rutherford apresentava uma importante limitação. Ele estava fundamentado nas leis da Física Clássica, que indicavam que partículas carregadas, ao girarem em torno de um núcleo, deveriam perder energia continuamente por meio da emissão de radiação eletromagnética. Esse processo levaria à colisão dos elétrons com o núcleo, resultando no colapso do átomo, o que, na prática, tornaria a existência dos átomos impossível. Essa instabilidade teórica destacava a necessidade de um modelo mais refinado, que foi posteriormente proposto por Niels Bohr.
→ Modelo atômico de Bohr
Em 1913, o físico dinamarquês Niels Bohr apresentou um modelo atômico inovador que representou um marco na história da ciência. Esse foi o primeiro modelo totalmente matemático da estrutura atômica, baseado em observações experimentais e conceitos previamente estabelecidos por outros cientistas, como Ernest Rutherford e Max Planck. Bohr foi pioneiro ao introduzir os fundamentos da então recente Mecânica Quântica, utilizando as ideias revolucionárias de Planck sobre energia quantizada.
Para entender o modelo de Bohr, é essencial compreender o conceito de quanta, proposto por Max Planck em 1900. Segundo Planck, a energia não é emitida ou absorvida de forma contínua, mas em pequenos pacotes discretos chamados quanta (plural de quantum). Cada quantum representa uma quantidade específica de energia, determinada pela equação:
\(E = h \cdot f\)
onde E é a energia do quantum, h é a constante de Planck (6,626 × 10−34 J \(\cdot\) s) e f é a frequência da radiação associada.
Bohr utilizou essa ideia para explicar o comportamento dos elétrons no átomo. Em vez de perderem energia continuamente, como previam as leis da Física Clássica, os elétrons no modelo de Bohr só podem possuir valores específicos de energia, relacionados a suas órbitas.
Bohr propôs que os elétrons giram em torno do núcleo em órbitas específicas e estacionárias, cada uma associada a uma energia fixa. Nessas órbitas, os elétrons não emitem nem perdem energia, o que solucionou o problema da instabilidade do modelo de Rutherford. Esse modelo clássico previa que os elétrons, ao girarem em torno do núcleo, perderiam energia continuamente e colapsariam sobre o núcleo, o que tornaria a existência do átomo impossível.
No modelo de Bohr, a energia de um elétron é quantizada, ou seja, só pode assumir valores específicos, o que evita a emissão contínua de radiação e garante a estabilidade do átomo. Bohr também introduziu o conceito de níveis de energia, que correspondem às órbitas fixas dos elétrons em torno do núcleo. Esses níveis são também conhecidos como camadas eletrônicas e são identificados pelas letras K, L, M, N, O, P, Q, sendo K o nível mais próximo do núcleo e Q, o mais distante. Cada camada possui uma quantidade específica de energia, aumentando à medida que se afasta do núcleo.
A ideia central é que os elétrons podem ocupar apenas essas camadas discretas e não posições intermediárias. Enquanto permanecem em uma órbita, os elétrons mantêm sua energia constante, sem emitir nem absorver radiação.
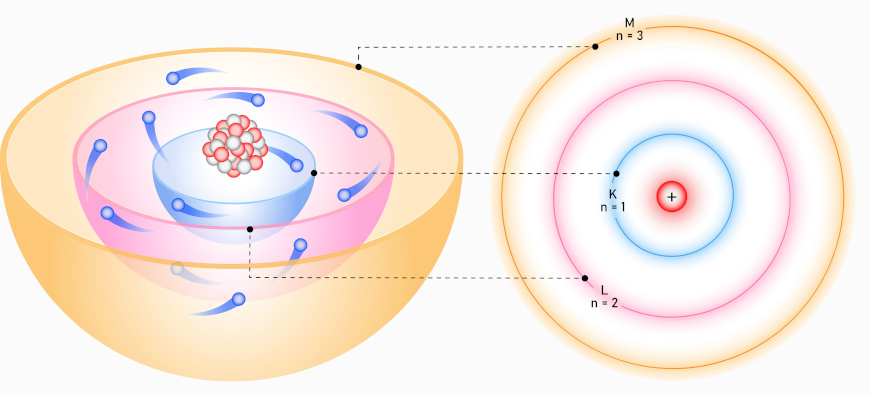
Uma característica fundamental do modelo de Bohr é a possibilidade de os elétrons realizarem transições eletrônicas. Esse fenômeno ocorre quando um elétron salta de uma camada para outra, absorvendo ou emitindo energia.
- Absorção de energia: quando o átomo recebe energia externa, como calor ou luz, os elétrons podem absorver essa energia na forma de um fóton. Essa energia adicional permite que o elétron salte para um nível de energia superior (mais distante do núcleo).
- Emissão de energia: após a excitação, o elétron retorna a um nível de energia mais baixo, liberando a energia absorvida na forma de luz visível.
A quantidade de energia emitida ou absorvida durante a transição é igual à diferença entre os níveis de energia envolvidos, sendo calculada pela equação:
\(\Delta E = E_2 - E_1 = h \cdot f \)
onde \(\Delta E\) é a diferença de energia, E2 e E1 são as energias dos níveis superior e inferior, respectivamente, e f é a frequência da radiação emitida ou absorvida.
O modelo de Bohr foi especialmente bem-sucedido na explicação do espectro de emissão do hidrogênio, um fenômeno observado quando átomos de hidrogênio excitados emitem luz ao retornarem a seus estados de energia mais baixos. Essa luz, ao ser decomposta, revela linhas coloridas específicas, correspondentes a diferentes comprimentos de onda. Cada linha no espectro representa a emissão de fótons devido às transições dos elétrons entre níveis específicos de energia.
O modelo de Bohr apresenta limitações, pois é insuficiente para explicar as complexidades das interações entre os elétrons e o núcleo de átomos multieletrônicos. Apesar disso, o modelo de Bohr permanece uma ferramenta essencial no ensino da Química e da Física, graças à sua simplicidade e capacidade de explicar fenômenos como a emissão de luz e a estabilidade do átomo.
→ Modelo atômico quântico ou modelo atômico de Schrödinger
O modelo quântico, também chamado de modelo de Schrödinger, surgiu como uma evolução dos modelos anteriores, integrando as contribuições de Rutherford e Bohr com ideias avançadas da Mecânica Quântica, como:
- A dualidade onda-partícula: proposta por Louis de Broglie, descreveu os elétrons como partículas que exibem comportamento ondulatório.
- O princípio da incerteza de Heisenberg: afirma ser impossível determinar simultaneamente a posição e a velocidade de um elétron com precisão absoluta.
Em 1926, o físico austríaco Erwin Schrödinger propôs um novo modelo atômico, baseado na Mecânica Quântica, que substituiu a ideia de órbitas fixas dos elétrons no modelo de Bohr. Em vez de descrever os elétrons como partículas localizadas em trajetórias definidas ao redor do núcleo, Schrödinger desenvolveu uma descrição matemática mais precisa, que incorpora a dualidade onda-partícula e o princípio da incerteza, conceitos fundamentais da Física Moderna.
O conceito de dualidade onda-partícula foi proposto por Louis de Broglie em 1924. Segundo De Broglie, as partículas, como os elétrons, não são exclusivamente partículas, mas podem também exibir comportamento ondulatório.
A onda associada a um elétron é descrita por uma função de onda, representada pela letra grega \(\Psi \) (psi). A partir dessa função de onda, Schrödinger desenvolveu uma equação que descreve a probabilidade de encontrar um elétron em uma região específica ao redor do núcleo atômico, baseado no princípio da incerteza.
O princípio da incerteza foi formulado por Werner Heisenberg em 1927. Esse princípio afirma que não é possível determinar, simultaneamente e com precisão, a posição e o momento (ou velocidade) de uma partícula, como um elétron. Quanto mais precisamente tentamos medir uma dessas grandezas, menos precisão teremos na outra. Em termos matemáticos, o princípio da incerteza é expresso pela relação:
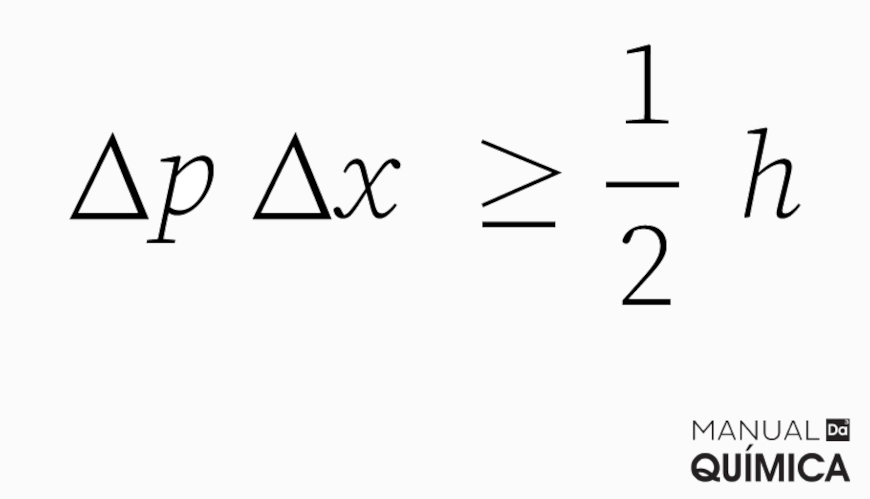
onde \(\Delta x \) é a incerteza na posição, \(\Delta p \) é a incerteza no momento da partícula, e h é a constante de Planck.
Esse princípio introduziu a ideia de que os elétrons não podem ser descritos como partículas com trajetórias bem definidas, mas sim como probabilidades de estarem em determinadas regiões.
Com base nas ideias de De Broglie e Heisenberg, Schrödinger formulou uma equação matemática, conhecida como equação de Schrödinger, que descreve a função de onda (\(\Psi \)) de um elétron em um átomo. A solução dessa equação fornece informações sobre a probabilidade de encontrar o elétron em diferentes regiões ao redor do núcleo. Essa probabilidade é representada pelo quadrado da função de onda, ou seja, \(\Psi^2 \).
Assim, em vez de descrever a posição exata de um elétron, o modelo de Schrödinger descreve regiões do espaço onde a probabilidade de encontrar o elétron é alta. Essas regiões de alta probabilidade são chamadas de orbitais atômicos.
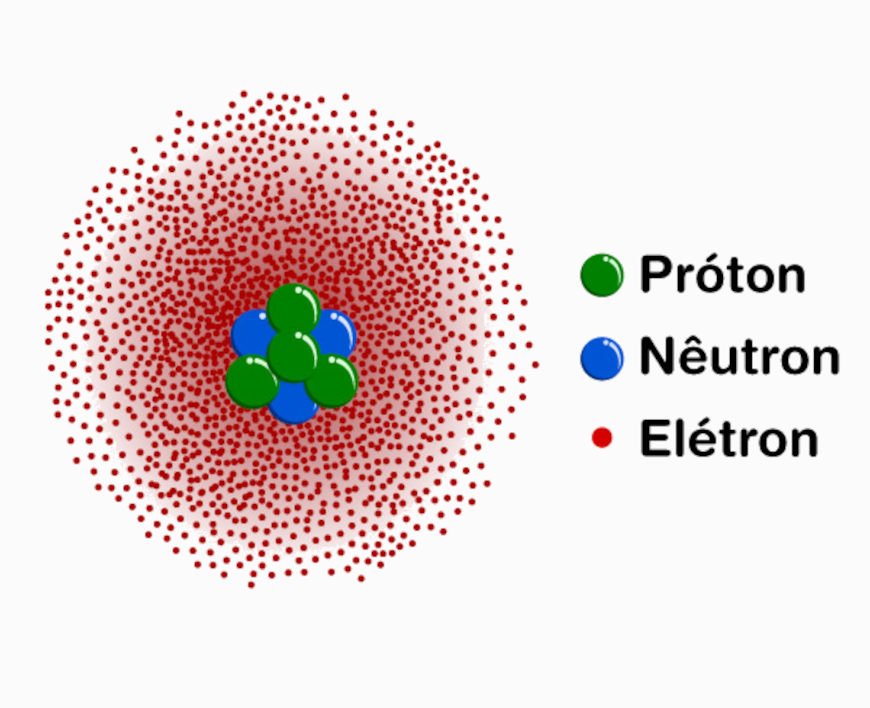
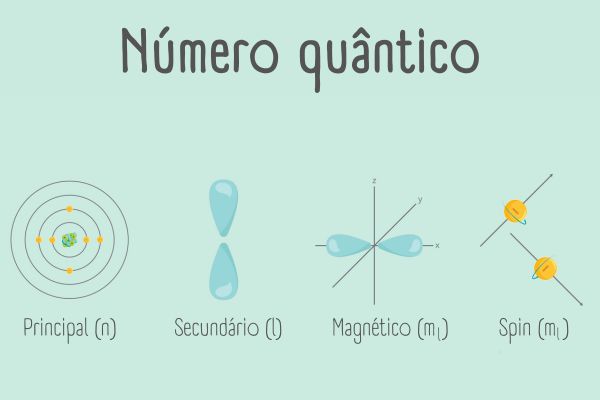
Em termos simples, um orbital atômico é uma região espacial onde há maior chance de localizar o elétron em um dado momento. Cada orbital tem uma forma e uma energia específicas, que dependem de três números quânticos: o número quântico principal (n), o número quântico angular (l) e o número quântico magnético (ml).
Existem diferentes tipos de orbitais, cada um com uma forma característica. Os orbitais s têm uma forma esférica, os orbitais p têm forma de “lóbulos”, os orbitais d têm formas mais complexas e assim por diante. A quantidade de orbitais e suas energias depende do nível de energia do átomo, o que determina os possíveis estados que os elétrons podem ocupar.
O modelo atômico de Schrödinger é a base da Mecânica Quântica moderna e representa um avanço significativo em relação aos modelos anteriores, apresentando uma descrição muito mais precisa e eficaz, explicando os fenômenos atômicos e moleculares de forma muito mais detalhada e confiável.
Saiba mais: Como os elétrons estão distribuídos nas camadas do átomo
Exercícios resolvidos sobre evolução dos modelos atômicos
Questão 1: (Unicentro) O desenvolvimento dos modelos atômicos é um excelente exemplo de como os modelos científicos se desenrolam e são, constantemente, revisados. O modelo atual foi desenvolvido a partir de estudos de diferentes pesquisadores e séries de experimentos.
Sobre os modelos atômicos, assinale a alternativa correta.
A) Segundo Bohr, os elétrons circulam ao redor do núcleo em determinadas órbitas de energia.
B) Segundo Dalton, átomos são esferas constituídas de partículas subatômicas.
C) J.J. Thomson propôs a existência de partículas positivas (prótons) em uma esfera negativa.
D) Segundo Rutherford, o átomo tem o núcleo positivo mais leve, com elétrons pesados ao redor.
E) Segundo o modelo de subníveis de energia, um átomo com Z = 22 tem configuração 1s2 2s2 2p6 3s2 3d10.
Resposta: A alternativa correta é a letra A): Segundo Bohr, os elétrons circulam ao redor do núcleo em determinadas órbitas de energia.
Analisando as alternativas:
- A) Correta: o modelo atômico de Bohr propôs que os elétrons giram em torno do núcleo em órbitas circulares específicas, quantizadas, ou seja, com níveis de energia definidos. Essa ideia, revolucionária na época, ajudou a explicar a emissão de luz por átomos.
- B) Incorreta: Dalton, um dos primeiros a propor um modelo atômico, imaginava os átomos como esferas maciças e indivisíveis. Ele não tinha conhecimento das partículas subatômicas como prótons, nêutrons e elétrons.
- C) Incorreta: o modelo de Thomson, conhecido como "pudim de ameixas", propunha um átomo como uma esfera de carga positiva com elétrons (as passas) incrustados nela. Ele não mencionava a existência de prótons de forma explícita.
- D) Incorreta: Rutherford, através de seu experimento com lâminas de ouro, concluiu que o átomo possui um núcleo central pequeno, denso e positivo, enquanto os elétrons ocupam a maior parte do volume atômico. Ele não considerava o núcleo mais leve e os elétrons mais pesados.
- E) Incorreta: a configuração eletrônica apresentada não está correta para um átomo com número atômico Z = 22. A distribuição correta seria 1s2 2s2 2p6 3s2 3p6 4s2 3d2.
Questão 2: (UFJF-MG) Associe as afirmações a seus respectivos responsáveis:
- O átomo não é indivisível, e a matéria possui propriedades elétricas (1897).
- O átomo é uma esfera maciça (1808).
- O átomo é formado por duas regiões denominadas núcleo e eletrosfera (1911).
A) I - Dalton, II - Rutherford, III - Thomson.
B) I - Thomson, II - Dalton, III - Rutherford.
C) I - Dalton, II - Thomson, III - Rutherford.
D) I - Rutherford, II - Thomson, III - Dalton.
E) I - Thomson, II - Rutherford, III - Dalton.
Resposta: A resposta correta é a alternativa B): I - Thomson, II - Dalton, III - Rutherford.
Vamos analisar cada afirmação e associá-la ao cientista responsável:
- I - O átomo não é indivisível e a matéria possui propriedades elétricas (1897): essa afirmação está associada a J.J. Thomson. Através de seus experimentos com tubos de raios catódicos, Thomson concluiu que os átomos possuíam partículas subatômicas com carga negativa, os elétrons. Essa descoberta desafiou a ideia de que o átomo era indivisível, como proposto por Dalton.
- II - O átomo é uma esfera maciça (1808): essa afirmação pertence a John Dalton. Seu modelo atômico, conhecido como "modelo da bola de bilhar", descrevia o átomo como uma esfera maciça, indivisível e indestrutível. Essa ideia, embora simples, foi um marco importante para a compreensão da matéria naquela época.
- III - O átomo é formado por duas regiões denominadas núcleo e eletrosfera (1911): essa afirmação se refere ao modelo atômico de Ernest Rutherford. Através do experimento da lâmina de ouro, Rutherford propôs que o átomo possuía um núcleo central, onde se concentrava a carga positiva e a maior parte da massa, e uma eletrosfera, região ao redor do núcleo onde se encontravam os elétrons.
Fontes
BROWN, Theodore L. et al. Química: a ciência central. 9.ed. São Paulo: Prentice Hall, 2005.
CHANG, Raymond. Química Geral: Conceitos Essenciais; 4ªed.; São Paulo;McGraw-Hill;2007.