Ebulição
A ebulição é o processo em que um líquido passa rapidamente para o estado gasoso quando é aquecido até uma temperatura específica, chamada de ponto de ebulição.
Por Everton da Paz Silva

PUBLICIDADE
A ebulição é o processo em que uma substância no estado líquido passa rapidamente para o estado gasoso ao ser aquecida até uma temperatura específica que é chamada de ponto de ebulição. Quando o líquido é aquecido, as moléculas ganham energia e passam a se mover mais rapidamente. Isso favorece a quebra de interações entre as moléculas, permitindo que elas escapem mais facilmente para o estado de vapor, aumentando a pressão do vapor sobre o líquido. Quando a pressão de vapor do líquido se iguala à pressão atmosférica (1 atm), são formadas bolhas de vapor no interior do líquido, caracterizando o ponto de ebulição.
O ponto de ebulição é uma propriedade específica da matéria que é utilizada para caracterizar e separar diferentes substância presentes em misturas, sendo de extrema importância em diferentes processos domésticos, industriais e laboratoriais.
Leia também: O que é combustão?
Resumo sobre ebulição
- A ebulição é um processo em que uma substância líquida passa rapidamente para o estado gasoso ao ser aquecida até uma temperatura específica.
- Durante o aquecimento, as moléculas convertem energia térmica em energia cinética e isso diminui a interação entre as moléculas, fazendo com que elas passem facilmente para o estado de vapor.
- A ebulição é caracterizada pela formação de bolhas de vapor no interior do líquido, formadas quando a pressão de vapor se iguala à pressão atmosférica (1 atm).
- A temperatura específica em que ocorre a passagem rápida do estado líquido para o estado gasoso é chamada de ponto de ebulição (PE).
- O PE é específico para cada substância. Por exemplo, a água tem PE = 100 °C enquanto o etanol tem PE = 78 °C.
- O ponto de ebulição (PE) é a temperatura específica em que a substância passa para o estado gasoso.
- O ponto de fusão (PF) é a temperatura específica em que a substância passa do estado sólido para o estado líquido.
- As mudanças de estado físico da matéria são:
- Fusão: passagem do estado sólido para o estado líquido.
- Solidificação: passagem do estado líquido para o estado sólido.
- Vaporização: passagem do estado líquido para o estado gasoso. Essa passagem pode ocorrer lentamente (evaporação), rapidamente (ebulição) ou instantaneamente (calefação).
- Condensação: passagem do estado gasoso para o estado líquido.
- Sublimação: passagem do estado sólido para o gasoso.
- Ressublimação (deposição): passagem do estado gasoso para o estado sólido.
O que é ebulição?
A ebulição é um processo de mudança de fase da matéria, em que uma substância passa rapidamente do estado líquido para o estado gasoso. O processo ocorre quando um líquido é aquecido até alcançar uma temperatura específica, chamada de ponto de ebulição.
Como ocorre a ebulição?
A ebulição ocorre quando um líquido é submetido a aquecimento, em que a energia térmica recebida é convertida em energia cinética. Com isso, as moléculas passam a se mover com maior velocidade, diminuindo as interações entre as moléculas.
Diante de uma diminuição das interações, as moléculas ficam livres para transitar para o estado gasoso, o que resulta no aumento da pressão de vapor. A pressão de vapor é a pressão exercida pelas moléculas em fase gasosa quando elas se encontram em equilíbrio termodinâmico com o líquido de origem.
À medida que moléculas escapam do líquido para o estado gasoso, há também moléculas que condensam e voltam à fase líquida, e esse processo ocorre de forma cíclica, até que a quantidade de líquido vaporizado se iguale à quantidade de vapor condensado, caracterizando o equilíbrio termodinâmico.
Quando ocorre o equilíbrio termodinâmico, a pressão de vapor se iguala à pressão atmosférica (1 atm) e a temperatura do líquido permanece constante. Esse processo é caracterizado pela formação de bolhas no interior do líquido, indicando que a ebulição está ocorrendo.
Tabela de ponto de ebulição
Cada substância apresenta um ponto de ebulição (PE) característico e a tabela abaixo lista algumas substâncias comuns no cotidiano.
|
Substância |
Fórmula química |
Ponto de ebulição (°C) |
|
Metano |
CH4 |
-161 |
|
Butano |
C4H10 |
-1 |
|
Propano |
C3H8 |
-42 |
|
Acetona |
C3H6O |
56 |
|
Metanol |
CH3OH |
65 |
|
Etanol |
C2H5OH |
78 |
|
Benzeno |
C6H6 |
80 |
|
Água |
H2O |
100 |
|
Tolueno |
C7H8 |
111 |
|
Ácido acético |
CH3COOH |
118 |
|
Glicerina |
C3H8O3 |
290 |
|
Ácido sulfúrico |
H2SO4 |
337 |
|
Mercúrio |
Hg |
357 |
|
Cloreto de sódio |
NaCl |
1465 |
O que é ponto de ebulição?
O ponto de ebulição é a temperatura em que ocorre a ebulição. Essa temperatura é diferente para cada substância, o que a torna uma propriedade específica da matéria. Uma propriedade específica é uma característica única de uma substância e a diferencia de outras substâncias.
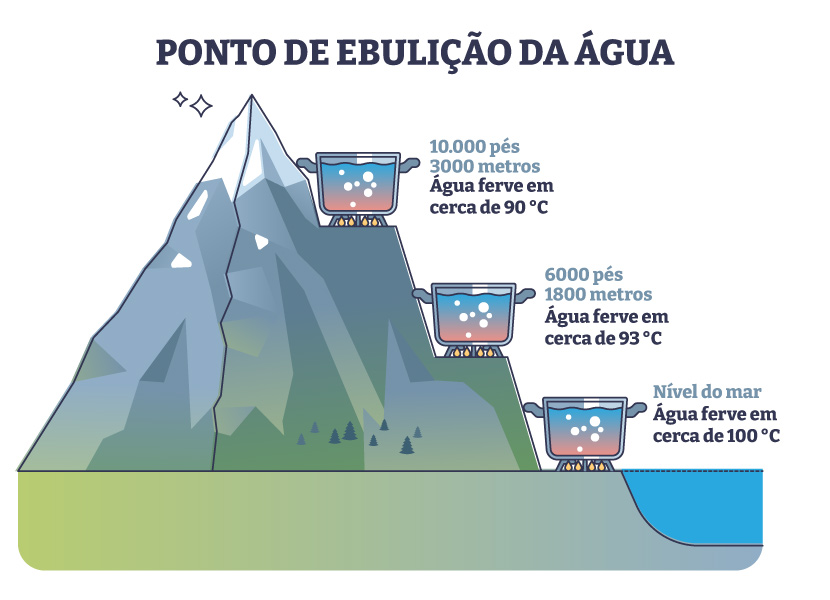
→ Ponto de ebulição da água
A água é uma substância que apresenta um ponto de ebulição de 100 °C, quando aquecida ao nível do mar, em que a pressão atmosférica é de 1 atm. Porém, quando a água é aquecida em regiões acima do nível do mar, a ebulição ocorre mais rapidamente devido a uma diminuição da pressão atmosférica. É o que se observa quando a água é aquecida em Brasília, por exemplo, onde o ponto de ebulição cai para aproximadamente 98,3 °C.
Isso ocorre porque a cidade de Brasília está localizada no Planalto Central, com altitude entre 1000 e 1200 metros acima do nível do mar. O contrário também é observado, em regiões abaixo do nível do mar, onde a água sofre ebulição em temperaturas maiores devido a um aumento da pressão atmosférica.
Em geral, o ponto de ebulição tem relação direta com a pressão atmosférica, que varia de acordo com a localidade. A pressão atmosférica é o peso da coluna de ar situada acima de determinado ponto.
Quanto mais alto, em relação ao nível do mar, menor é o ponto de ebulição devido à menor pressão atmosférica, e, quanto mais abaixo do nível do mar, maior o ponto de ebulição devido ao aumento da pressão atmosférica. A imagem abaixo ilustra a mudança no ponto de ebulição da água em diferentes altitudes.
Ponto de fusão x ponto de ebulição
O ponto de fusão (PF) é a temperatura em que uma substância passa do estado sólido para o estado líquido, sob pressão de 1 atm, diferentemente do ponto de ebulição (PE), que se refere à temperatura em que determinada substância passa do estado líquido para o estado gasoso sob 1 atm. Em geral, tanto o PF quanto o PE são propriedades específicas da matéria, utilizadas para diferenciar substâncias.
Mudanças de estado físico da matéria
A mudança de estado físico de uma substância é mediada pela relação de ganho e perda de energia pelas moléculas que compõem a substância.
A energia associada a átomos e moléculas é, em partes, energia cinética (energia do movimento) — o conjunto dos movimentos de rotação, translação e vibração. É essa energia cinética que define o grau de agitação das moléculas, medido pela temperatura.
Quando as moléculas recebem energia, o grau de agitação aumenta, fazendo com que as forças de agregação diminuam, permitindo que as moléculas passem para um estado de agregação mais disperso (de menor interação). De forma contrária, quando as moléculas perdem energia, ocorre uma diminuição do grau de agitação, fazendo com que as moléculas se aproximem mais e aumentem as interações entre si.
Essa diferença no grau de agitação define os estados físicos da matéria (sólido, líquido e gasoso), também chamados de estados de agregação, como descritos na ilustração abaixo.
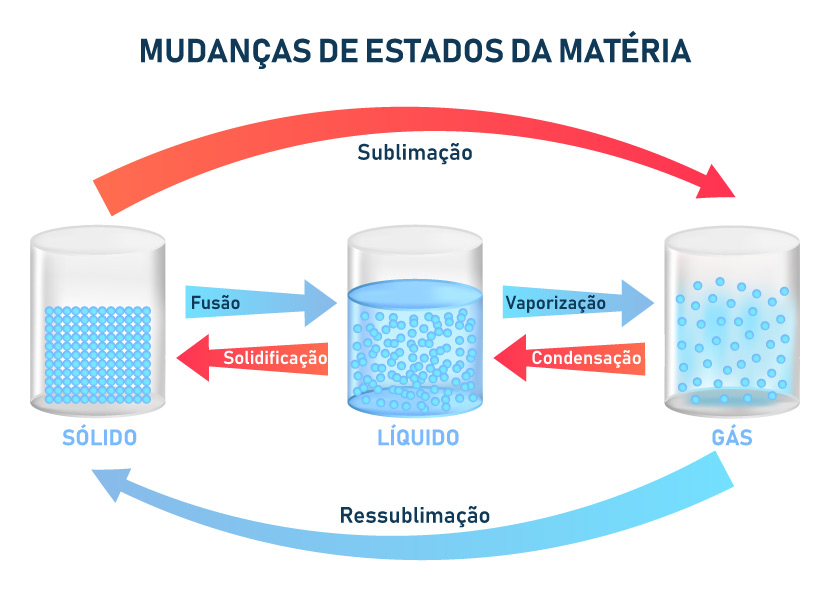
Os diferentes processos de mudança de fase da matéria são:
- Fusão: é o processo de passagem do estado sólido para o estado líquido, que ocorre devido a um aumento de temperatura, ou seja, aumento do grau de agitação.
- Solidificação: processo inverso à fusão, é a passagem do estado líquido para o estado sólido e ocorre devido a uma diminuição de temperatura, ou seja, diminuição do grau de agitação.
- Vaporização: é o processo de passagem do estado líquido para o estado gasoso, que ocorre devido a um aumento de temperatura (aumento do grau de agitação). A vaporização pode ocorrer de três formas distintas:
- Evaporação: passagem lenta do estado líquido para o gasoso. Ocorre lentamente diante das variações sutis de temperatura do ambiente. O processo é muito lento e pode ser percebido pela diminuição do nível do líquido. Um exemplo são porções de água parada em recipientes e no chão.
- Ebulição: passagem rápida do estado líquido para o gasoso. Ocorre durante o aquecimento do líquido, quando determinada temperatura é atingida. Um exemplo é a fervura da água, processo muito comum no preparo de chás, cafés e cozimento de alimentos. É caracterizada pela formação de bolhas no interior do líquido.
- Calefação: passagem instantânea do estado líquido para o gasoso. Ocorre de forma brusca, quando líquido entra em contato com uma superfície que está em uma temperatura muito alta. Um exemplo é a água jogada imediatamente em cima de frigideiras e chapas após ser cessado o aquecimento. É caracterizada por um barulho de chiado e uma fumaça, originada da grande quantidade de vapor formado.
- Condensação ou liquefação: processo inverso à vaporização, é a passagem do estado gasoso para o estado líquido, que ocorre devido à diminuição de temperatura (diminuição do grau de agitação).
- Sublimação: é o processo de passagem direta do estado sólido para o estado gasoso e ocorre devido a um aumento da temperatura, ou seja, um aumento do grau de agitação das moléculas do sólido.
- Ressublimação ou deposição: processo inverso à sublimação, é a passagem direta do estado gasoso para o estado sólido e ocorre devido a uma diminuição da temperatura.
Acesse também: Afinal, o que é matéria?
Exercícios resolvidos sobre ebulição
Questão 1
(UFT) A tabela apresenta as constantes físicas de alguns cicloalcanos:
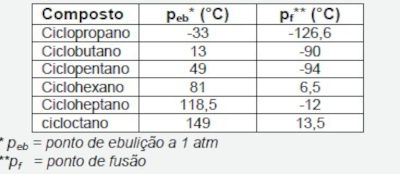
Com relação aos compostos apresentados na tabela, assinale a alternativa INCORRETA.
A) O ciclopropano é um gás à temperatura ambiente (25 ºC).
B) O ponto de ebulição varia de acordo com o número de átomos de carbono.
C) Os cicloalcanos de 4 a 8 átomos de carbono são líquidos à temperatura ambiente (25 ºC).
D) A conformação adotada pelo anel dos cicloalcanos afeta diretamente o ponto de fusão.
Resposta:
Alternativa C.
De acordo com a tabela com os valores de ponto de ebulição e fusão apresentada na questão, podemos concluir que:
- A alternativa A está correta, pois a tabela indica que o ciclopropano entra em ebulição a -33 °C. Isso significa que em 25 °C, temperatura ambiente, o composto está no estado gasoso.
- A alternativa B também está correta, pois o ponto de ebulição é uma propriedade que depende da massa e das interações moleculares existentes. O aumento do número de carbonos se reflete em um aumento do número de massa da substância e, consequentemente, no aumento do número de interações. Por isso, o ponto de ebulição aumenta com o número de carbonos.
- A alternativa C é alternativa incorreta, pois afirma que os cicloalcanos de 4 a 8 átomos de carbono são líquidos em 25 °C, o que não é verdade, pois o ciclobutano apresenta 4 carbonos na sua estrutura e o seu ponto de ebulição (PE), na tabela, é de 13 °C. Com esse valor de PE, o ciclobutano já estará no estado gasoso em 25 °C.
- A alternativa D também está correta, pois a conformação de cicloalcanos favorece um aumento no número de interações devido a uma maior compactação das substâncias. Como a quantidade de interações aumenta, o ponto de ebulição tende a ser maior.
Questão 2
(Enem) A água sofre transições de fase sem que ocorra variação da pressão externa. A figura representa a ocorrência dessas transições em um laboratório.

Tendo como base as transições de fase representadas (1 a 4), a quantidade de energia absorvida na etapa 2 é igual à quantidade de energia
A) liberada na etapa 4.
B) absorvida na etapa 3.
C) liberada na etapa 3.
D) absorvida na etapa 1.
E) liberada na etapa 1.
Resolução:
Alternativa E.
A questão aborda o conceito de energia envolvida nas mudanças de fase da água e, nesse contexto, é importante entender que a quantidade de energia liberada no processo 1 (condensação) é a mesma quantidade de energia absorvida no processo 2 (vaporização), por se tratar do processo inverso.
É importante lembrar que o estado gasoso é um estado de maior energia cinética, e, para que as moléculas possam alcançar esse estado, precisam ganhar energia. De forma contrária, o estado líquido é um estado de menor energia cinética, em comparação ao estado gasoso. Por isso, para que a substância volte ao estado líquido, é necessário que libere a mesma quantidade de energia que é absorvida durante a vaporização.
Essa relação de quantidade de energia ganha, e liberada, no decorrer dos processos é válida para todos os processos de mudança de fase.
A imagem mostra a ordem dos processos no sentido inverso, diferente da forma tradicional de apresentação do esquema de mudanças de fase. Entretanto, os estados físicos são descritos abaixo e explicitados pela ilustração, o que facilita a interpretação.
Fontes
ATKINS, P. W. PAULA, J. de. Fundamentos de Físico-Química. Vol 1 & 2. 5 ed. Rio de Janeiro: LTC, 2003.
ATKINS, Peter; JONES, Loretta; Princípios de química: questionando a vida moderna e o meio ambiente. 3ª ed. Porto Alegre: Bookman, 2006.
CHANG, Raymond; Química Geral: Conceitos Essenciais. 4ª ed. São Paulo: McGraw-Hill, 2007.
ROCHA, Willian R. Interações intermoleculares. Caderno temático 4. Quím. Nova Esc., p.31-36, 2001.