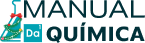Energia de ionização
A energia de ionização é a energia necessária para retirar um elétron de um átomo ou íon no estado gasoso.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
Os átomos no estado fundamental possuem a mesma quantidade de prótons (cargas positivas) e de elétrons (cargas negativas), ou seja, são neutros. Mas na formação das ligações iônicas, ocorre a extração de um ou mais elétrons da camada de valência do átomo, que são transferidos para outro átomo, resultando na formação de íons. O átomo que perdeu os elétrons transforma-se em um cátion (espécie carregada positivamente).
Para “arrancar” esses elétrons do átomo isolado ou de um íon, é necessário aplicar uma determinada quantidade de energia, que é chamada de energia de ionização (porque houve a formação de íons) ou potencial de ionização. Assim, podemos fazer a seguinte definição:
“Energia de ionização ou potencial de ionização é a energia aplicada para retirar um elétron do átomo (ou do íon) isolado no estado gasoso.”
X(g) → X+(g) + e- I = E(X+) - E(X)
Os valores das energias de ionização podem ser expressos em eletrovolts (eV), mas de acordo com o SI (Sistema Internacional de Unidades), eles devem ser expressos em kJ/mol.
Quando se retira o primeiro elétron de um átomo neutro, há a primeira energia de ionização (I1). Já a energia necessária para retirar o segundo elétron desse cátion que foi formado é chamada de segunda energia de ionização (I2) e assim por diante. A primeira energia de ionização é sempre menor que a segunda energia de ionização e assim sucessivamente. Isso acontece porque, no primeiro caso, o elétron está na camada mais externa ao núcleo e, como está mais longe dos prótons, a atração entre eles é menor, sendo mais fácil retirar o elétron.
Por exemplo, consideremos um átomo de cobre (Cu(g)) que possui quatro níveis de energia no estado fundamental e um elétron no subnível mais externo (4s1):
29Cu +785 kJ/mol → 29Cu+ + e-
29Cu + 1955 kJ/mol → 29Cu2+ + e-
Veja que a segunda energia de ionização foi maior do que a primeira. Isso nos mostra que a energia de ionização é uma propriedade periódica, que varia conforme o número atômico dos átomos dos elementos da Tabela Periódica. Podemos notar também que essa propriedade segue um padrão de variação relacionado com o do raio atômico, pois depende da distância que os elétrons estão do núcleo, ou seja, quanto maior o raio atômico, menor a energia de ionização e vice-versa.
Isso quer dizer que os valores das energias de ionização dos elementos crescem no sentido oposto ao crescimento do raio atômico, ou seja, aumenta de baixo para cima e da esquerda para a direita. Os valores das energias de ionização são medidos experimentalmente e podemos comparar esses valores para confirmarmos esse padrão de variação mencionado:
Representações dos valores da primeira energia de ionização de alguns átomos
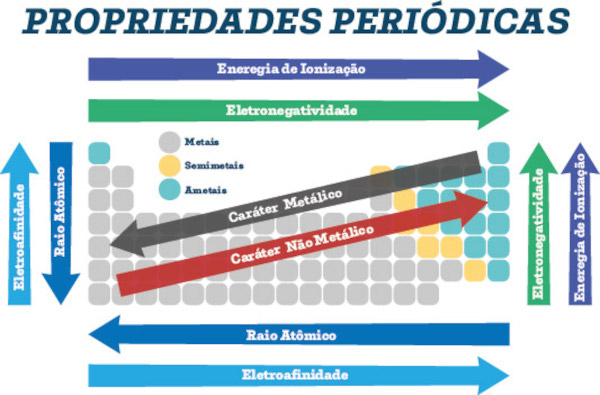
* Considerando os elementos em uma mesma família: A primeira energia de ionização aumenta de baixo para cima. Isso acontece porque, conforme vai descendo, os níveis de energia e o raio atômico vão aumentando e os elétrons vão ficando mais distantes do núcleo, por isso fica mais fácil retirá-los. Por exemplo, o H (hidrogênio) possui somente uma camada eletrônica, então seu elétron está bem próximo ao núcleo. Já o Cs (césio) possui seis camadas eletrônicas, estando seus elétrons bem distantes do núcleo. É por isso que a energia de ionização do H é bem maior (1312) que a do Cs (376).

Átomos de césio e hidrogênio
* Considerando os elementos em um mesmo período: A primeira energia de ionização aumenta da esquerda para a direita. Isso ocorre porque, conforme vai caminhando para a direita, a quantidade de níveis permanece a mesma, mas a quantidade de elétrons vai aumentando, ou seja, a atração pelo núcleo aumenta e seu raio diminui. Com isso, a energia necessária para vencer essa força de atração precisará ser maior. Por exemplo, o Na (sódio) e o Ar (argônio) pertencem ao terceiro período, o que significa que ambos possuem três camadas eletrônicas, mas o Na possui somente um elétron na sua camada mais externa, enquanto o Ar possui oito elétrons nessa camada. Por isso, a primeira energia de ionização do Ar será bem maior (1521) que a do Na (496).
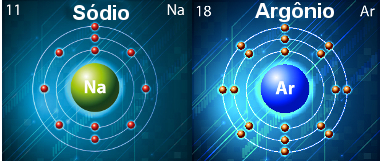
Átomos de sódio e argônio
Isso significa que os maiores valores para a energia de ionização são dos elementos situados próximos ao Hélio, ou seja, na parte superior à direita da Tabela Periódica. Por outro lado, os menores valores são dos elementos situados próximos ao césio, na parte inferior à esquerda da Tabela Periódica.

Relação entre a energia de ionização e as famílias e períodos na Tabela Periódica
Isso explica algumas propriedades dos elementos, como o fato de os elementos próximos ao Césio serem metais e os elementos próximos ao hélio serem ametais. Conforme o texto Ligação Metálica mostra, os metais são formados por aglomerados de átomos neutros e cátions mergulhados em uma “nuvem” ou “mar” de elétrons deslocalizados. Isso significa que eles devem ter maior facilidade de perder elétrons e, por isso, somente os elementos com baixa energia de ionização podem formar sólidos metálicos. Por outro lado, os elementos no canto superior à direita não possuem essa facilidade de perder elétrons, porque possuem altas energias de ionização e, por essa razão, são ametais.
Aproveite para conferir nossas videoaulas sobre o assunto: