Ligação Metálica
A alta eletropositividade dos metais levou os cientistas a criarem um modelo de ligação metálica baseado na atração entre cátions e elétrons em uma estrutura cristalina.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
Dos 112 elementos químicos que são apresentados na Tabela Periódica, 87 são metais. Os metais são cada vez mais usados em diversos setores da sociedade: o ferro é usado em estruturas metálicas de construções, é usado para fazer o aço, que é usado também nas construções, em veículos, fogões e geladeiras; o cobre é muito utilizado em fios elétricos e em moedas; o alumínio é usado em panelas e outros utensílios domésticos, em ligas leves e em latas; o magnésio é empregado em automóveis e partes de aviões, e os exemplos continuam.
Essa ampla diversidade de aplicações está relacionada às propriedades únicas dos metais, tais como a capacidade de conduzir calor e corrente elétrica, a maleabilidade (podem ser transformados em chapas e lâminas bem finas), a ductibilidade (podem ser transformados em fios), entre outras.
Todas essas propriedades podem ser explicadas por um modelo de ligação entre os átomos desses elementos chamado de ligação metálica.
Os átomos dos elementos metálicos agrupam-se de modo a formar arranjos cristalinos definidos, que são chamados de células, ou grades, ou retículos, ou, ainda, reticulados cristalinos, tais como os mostrados abaixo:
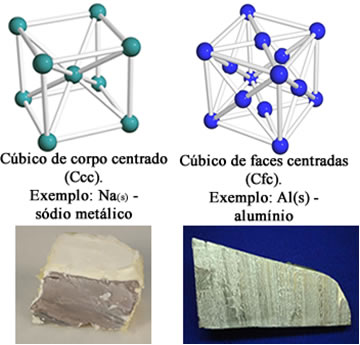
Exemplos de retículos cristalinos dos metais
Na realidade, o número de coordenação dos metais é enorme, o que significa que cada átomo é circundado por um número grande de outros átomos do mesmo elemento, cerca de 8 ou 12, e que o reticulado é formado, na verdade, por milhões de átomos.

O reticulado cristalino é formado por um número muito grande de átomos do metal
Os átomos dos metais geralmente possuem poucos elétrons na camada eletrônica mais externa, que também se apresenta bem afastada do núcleo atômico. Isso significa que eles são muito eletropositivos, ou seja, possuem uma forte tendência de perder esses elétrons, e é exatamente isso o que acontece, sendo que esses elétrons liberados são chamados de semilivres ou livres.
Os átomos que perdem os elétrons transformam-se em cátions (espécie química com carga positiva), sendo que os elétrons ficam de uma forma que tenham certa mobilidade ou movimentação na estrutura cristalina, mas não se desprendem, pois são atraídos por esses cátions. Alguns cátions, inclusive, recebem os elétrons e voltam a ficar neutros, e o processo continua acontecendo.
Assim, os metais são formados por aglomerados de átomos neutros e cátions, que estão circundados por uma “nuvem” ou “mar” de elétrons”, que funciona como a ligação metálica que mantém os átomos do metal unidos.
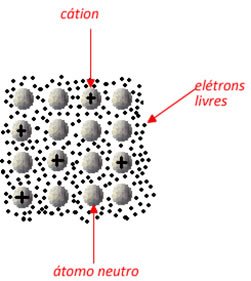
Teoria do mar ou nuvem de elétrons que mantém a ligação metálica
Diferentemente das ligações iônicas e covalentes, a ligação metálica não tem uma representação eletrônica. Visto que é formada por um número muito grande e indeterminado de átomos, a substância metálica é simbolizada somente pelo símbolo do elemento químico, que, na verdade, não existe na natureza na sua forma isolada.
Por exemplo, uma lâmina de zinco é formada por inúmeros átomos de zinco, bem como por seus cátions circundados por um mar de elétrons, mas é representado somente por Zn(s).
Esse modelo para a ligação metálica explica as três principais propriedades dos metais mencionadas no início do texto. Eles são bons condutores de corrente elétrica e de calor, porque a corrente elétrica nada mais é do que o movimento ordenado dos elétrons em uma direção. Visto que os metais possuem um “mar” de elétrons livres em sua estrutura cristalina, basta aplicar uma certa voltagem externa para que esses elétrons se dirijam ao polo positivo dessa fonte, formando a corrente elétrica. Tais elétrons também permitem a transmissão rápida de calor.
Já a maleabilidade e a ductibilidade vêm do fato de que os átomos dos metais podem “escorregar” uns sobre os outros.

A formação dos fios de cobre é possível em razão da ductibilidade que esse metal tem
Por Jennifer Fogaça
Graduada em Química
Aproveite para conferir nossas videoaulas relacionadas ao assunto: