Eletronegatividade
Eletronegatividade é a capacidade que um átomo tem de atrair elétrons de uma ligação química. É uma propriedade periódica inversamente proporcional ao raio atômico.
Por Stéfano Araújo Novais

PUBLICIDADE
Eletronegatividade é a tendência que um átomo tem a atrair para si os elétrons de uma ligação química. De certa forma, pode ser entendida como um poder de atração do átomo ou sua tendência a se tornar um ânion. A eletronegatividade foi criada por Linus Pauling, no ano de 1932.
A eletronegatividade é uma propriedade periódica, sendo ela inversamente proporcional ao raio atômico: quanto menor for o raio, maior será a eletronegatividade. Também pode ser interpretada como uma média aritmética entre a energia de ionização e a afinidade eletrônica. Por isso, ametais de raio pequeno, com alta afinidade eletrônica e alta energia de ionização, são os mais eletronegativos, com destaque para o flúor, que é o elemento mais eletronegativo da Tabela Periódica.
Leia também: Tabela Periódica — nomes dos elementos, organização e propriedades
Resumo sobre eletronegatividade
- A eletronegatividade é a tendência que um átomo possui de atrair para si os elétrons de uma ligação química.
- De certa forma, é uma medida do poder de atração de um átomo ou sua tendência a se tornar um ânion.
- Foi desenvolvida no ano de 1932, por Linus Pauling.
- A eletronegatividade é também uma propriedade periódica, sendo inversamente proporcional ao raio atômico, ou vista como uma média entre a energia de ionização e a afinidade eletrônica.
- Ametais de baixo raio atômico são os elementos mais eletronegativos da Tabela Periódica.
- O flúor é o elemento de maior eletronegatividade.
Videoaula sobre eletronegatividade
O que é eletronegatividade?
A eletronegatividade é um conceito que foi introduzido em 1932 por Linus Pauling, o qual apresenta a tendência que um átomo possui de atrair para si os elétrons de uma ligação química. Assim sendo, a eletronegatividade serve como uma medida quantitativa do poder de atração de um átomo.
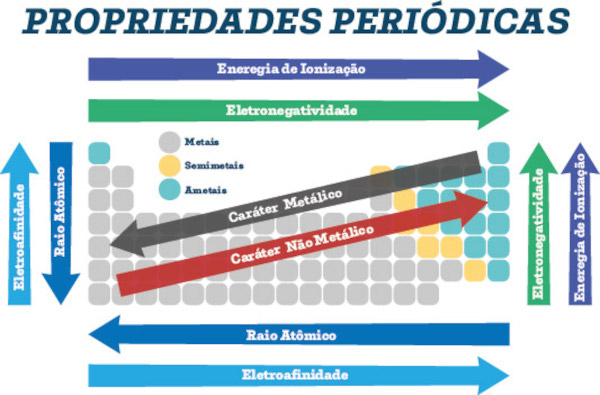
Eletronegatividade na Tabela Periódica
Embora a eletronegatividade tenha sido pensada por Pauling, originalmente, em termos de energia de dissociação de ligações, a contribuição feita por Robert Mulliken é muito interessante para estabelecer a eletronegatividade e correlacioná-la com as propriedades periódicas. Segundo Mulliken, a eletronegatividade (EN) é a média entre a energia de ionização (EI) e a afinidade eletrônica (AE) do elemento.
\(EN = \frac{(EI + AE)}{2}\)
Por essa lógica, um elemento terá alta eletronegatividade se:
- tiver uma alta energia de ionização, ou seja, perder o seu elétron de valência com facilidade;
- tiver uma alta afinidade eletrônica, ou seja, ligar-se a um elétron é energeticamente favorável.
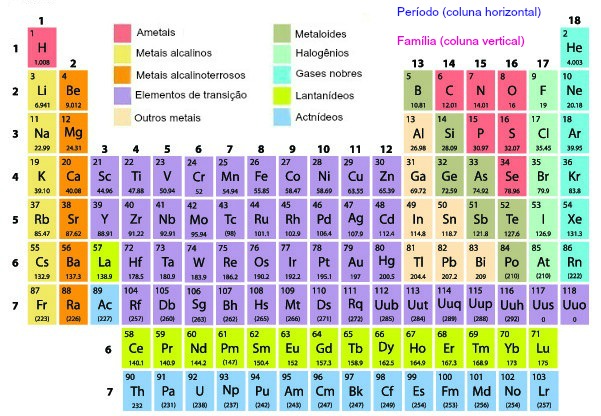
Dessa forma, os elementos que combinam essas duas características são os ametais de baixo raio atômico. Não à toa, o flúor (F), é o elemento mais eletronegativo da Tabela Periódica, seguido por elementos adjacentes, como oxigênio, cloro e nitrogênio. Os gases nobres são excetuados. A imagem a seguir, embora um pouco desatualizada, mostra bem a tendência de eletronegatividade dentro da Tabela Periódica:
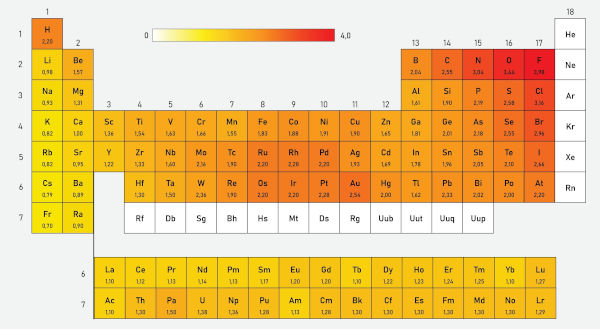
De certa forma, percebemos que a eletronegatividade é inversamente proporcional ao raio atômico e, assim sendo:
- cresce da esquerda para direita no período;
- cresce de baixo para cima no grupo.
Veja também: Como ocorre uma ligação química?
Fila de eletronegatividade
Com a ideia de que a eletronegatividade é inversamente proporcional ao raio atômico, podemos descrever, a seguir, os cinco elementos mais eletronegativos conhecidos até então:
|
F (3,98) > O (3,44) > Cl (3,16) > N (3,04) > Br (2,96) |
Já os cinco elementos menos eletronegativos conhecidos até então são:
|
Fr (0,7) < Cs (0,79) < Rb (0,82) < K (0,82) < Ba (0,89) |
Como saber a eletronegatividade de um elemento?
A eletronegatividade pode ser determinada por escalas distintas. A tabela a seguir mostra algumas escalas e suas formas de determinar a eletronegatividade:
|
Autor |
Método de definição |
|
Pauling |
Energias de dissociação da ligação |
|
Mulliken |
Média entre a energia de ionização e a afinidade eletrônica |
|
Allred e Rochow |
Atração eletrostática proporcional à carga nuclear efetiva pelo quadrado do raio (Z*/r2) |
|
Sanderson |
Densidade eletrônica dos átomos |
|
Pearson |
Média entre a energia de ionização e a afinidade eletrônica |
|
Allen |
Energia média de elétrons da camada de valência |
|
Jaffé |
Eletronegatividade do orbital |
Dessas formas de definição, a mais comum é a da Pauling. Como a forma de cálculo não é relativamente simples quando falamos de ensino básico, os valores de eletronegatividade são, em geral, informados. Quando não são diretamente informados, devemos nos atentar à tendência da eletronegatividade da Tabela Periódica: sendo o flúor o elemento mais eletronegativo, os valores de eletronegatividade caem em direção ao frâncio, Fr (canto inferior esquerdo da Tabela Periódica).
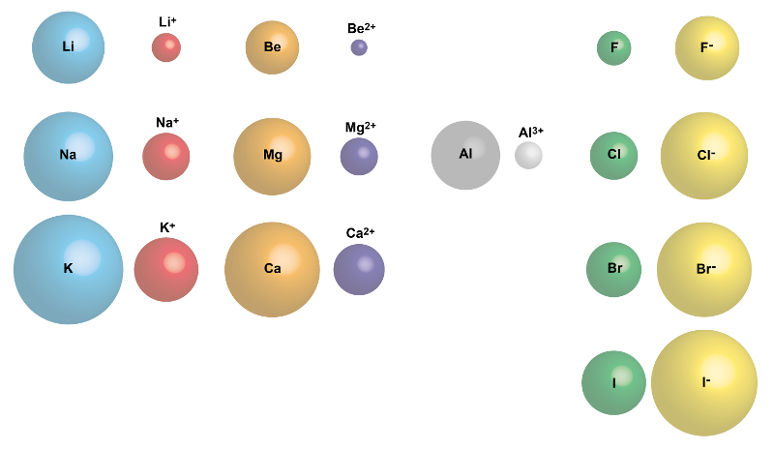
Eletronegatividade e eletropositividade
A eletropositividade é uma propriedade oposta à eletronegatividade, embora seja pouco utilizada ou definida pelos autores de maneira geral. Uma boa forma de correlacioná-la com a eletronegatividade é pensar que a eletronegatividade é a tendência de um átomo a formar ânions (uma vez que átomos mais eletronegativos, de certa forma, têm maior afinidade eletrônica) e, assim sendo, a eletropositividade é a tendência de um átomo a formar cátions.
Saiba mais: Como saber a eletropositividade de um elemento?
Exercícios resolvidos sobre eletronegatividade
Questão 1. (FUVEST/2024) Um tema de grande interesse na química é a ativação seletiva de ligações C-H. Essa ativação permite a substituição de H nessas ligações por outros átomos, como O ou N. A relevância desse tema pode ser verificada em um estudo recentemente publicado no prestigioso periódico Science, que conta com uma egressa da USP dentre seus autores.
A baixa diferença de eletronegatividade entre C e H é um dos motivos que dificulta a ativação da ligação C-H, pois torna a ligação pouco polar e diminui sua reatividade.
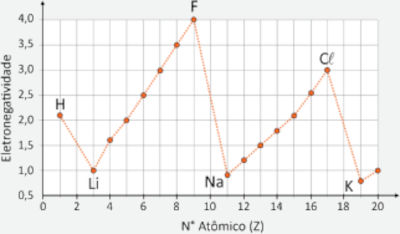
Considerando apenas a eletronegatividade, representada no gráfico, qual das alternativas apresenta uma ligação ainda menos reativa do que a ligação C-H?
Note e adote:
Número atômico (Z) dos elementos: H = 1, C = 6, N = 7, O = 8, F = 9, P = 15, S = 16, Cl = 17.
- C-N
- C-F
- S-O
- P-H
- P-Cl
Resposta: Letra D.
Pelo gráfico, percebe-se que a eletronegatividade do fósforo (P) é ainda menor que a do carbono (C). Devido a isso, a diferença de eletronegatividade com o hidrogênio é ainda menor, tornando a ligação P-H menos reativa do que a ligação C-H.
Questão 2. (CESMAC 2º dia/2021.1) A eletronegatividade mede a capacidade que um átomo possui de atrair o par de elétrons compartilhados em uma ligação covalente. Analisando os elementos fósforo, arsênio e nitrogênio (pertencentes ao mesmo grupo), a ordem decrescente de eletronegatividade é:
- P > N > As
- N > As > P
- As > P > N
- N > P > As
- As > N > P
Resposta: Letra D.
A ordem decrescente de eletronegatividade (do maior para o menor) será dada pelo tamanho do raio atômico: quanto menor o raio atômico, maior a eletronegatividade.
Nitrogênio (N): 2º período; logo, menor raio e, portanto, maior eletronegatividade.
Fósforo (P): 3º período; logo, segundo menor raio.
Arsênio (As): 4º período; logo, maior raio e, portanto, menor eletronegatividade.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
FRANCISCO, F. M.; DO CANTO, E. L. Química na abordagem do cotidiano. 5ª ed. vol. 1. São Paulo: Moderna, 2009.
MIESSLER, G. L.; FISCHER, P. J.; TARR, D. A. Química Inorgânica. 5. ed. Pearson Education do Brasil: São Paulo, 2014.
USBERCO, J.; SPITALERI, P.; SALVADOR, E. Química 1: conecte live. 3ª ed. vol. 1. São Paulo: Saraiva, 2018.
REIS, M. Química: ensino médio. 2ª ed. vol. 1. São Paulo: Ática, 2016.