Exceções à Regra do Octeto
Existem exceções à regra do octeto nas quais os átomos podem sofrer expansão ou contração do octeto, ficando estáveis com mais ou menos de oito elétrons na camada de valência.
Por Jennifer Rocha Vargas Fogaça
PUBLICIDADE
No texto Teoria do Octeto foi mostrado que um grande número de átomos adquire estabilidade com oito elétrons na camada de valência (ou dois elétrons quando há somente a primeira camada). Essa regra é uma ferramenta útil para a determinação teórica da fórmula dos compostos mais comuns formados por elementos representativos. No entanto, a teoria do octeto não nos ajuda a encontrar a fórmula de todos os compostos. Existem, portanto, exceções a essa regra.
Esses casos podem ocorrer de duas maneiras principais: (1) pode acontecer expansão do octeto, isto é, o átomo adquirir estabilidade com mais de oito elétrons na camada de valência, ou (2) pode ocorrer contração do octeto, quando o átomo adquire estabilidade com menos de oito elétrons na camada de valência. Vejamos alguns exemplos desses casos:
(1) Expansão do octeto:
Ocorre somente com átomos de elementos não metálicos do terceiro período em diante, ou seja, que possuem três ou mais camadas eletrônicas. Isso porque esses átomos possuem orbitais d vazios que podem acomodar 10, 12 ou mais elétrons.
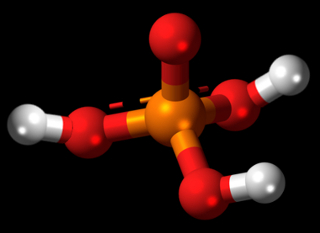
Um exemplo de elemento químico cujos átomos podem sofrer contração é o fósforo (P), que pertence à família 15 ou VA da tabela periódica. Isso significa que ele possui cinco elétrons na camada de valência e, segundo a teoria do octeto, deveria receber mais três elétrons para ficar estável com oito elétrons.
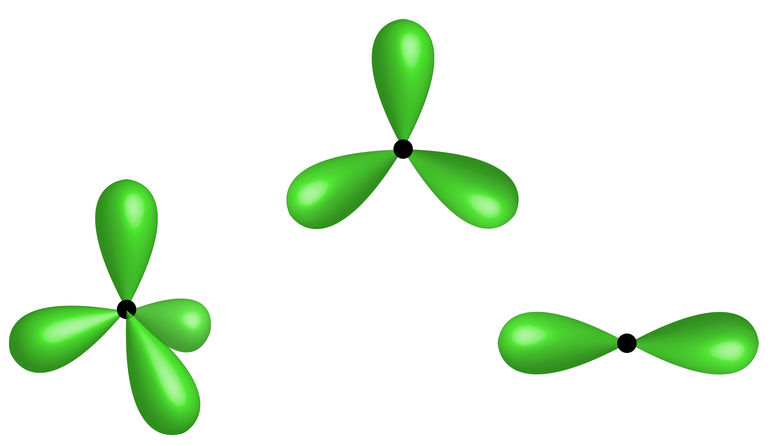
No entanto, observe o caso do composto fosfato de hidrogênio apresentado a seguir:
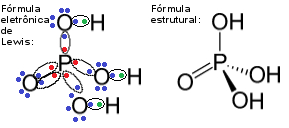
Fórmulas do fosfato de hidrogênio – uma exceção à regra do octeto
Veja que o fósforo é o elemento central desse composto e que ele realiza cinco ligações covalentes com quatro átomos de carbono. Visto que o átomo de fósforo compartilha cinco pares de elétrons, ele fica com um total de dez elétrons na camada de valência, ou seja, ele não seguiu a regra do octeto, mas houve uma expansão do seu octeto.
Outro elemento químico que também sofre comumente expansão do octeto é o enxofre (S). Veja os exemplos a seguir:
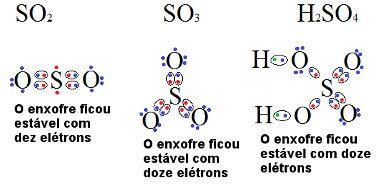
Fórmulas de compostos do enxofre que são exceções à regra do octeto
(1) Contração do octeto:
Ocorre principalmente com os átomos de elementos do segundo período da tabela periódica. O berílio e o boro são exemplos de elementos cujos átomos sofrem contração ao formar compostos.
Por exemplo, a seguir há a fórmula do dicloreto de berílio, na qual o berílio é o elemento central:
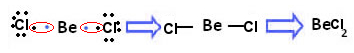
O dicloreto de berílio é um exemplo de exceção à regra do octeto
Veja que o berílio possui dois elétrons na camada de valência. Segundo a regra do octeto, ele deveria perder esses dois elétrons para ficar estável. No entanto, na molécula de dicloreto de berílio acima, isso não acontece. Na verdade, o berílio realiza duas ligações covalentes e fica estável com apenas quatro elétrons.
O alumínio é um elemento do terceiro período, mas ele pode sofrer contração do octeto e ficar estável com menos de oito elétrons na camada de valência. Isso acontece quando ele forma compostos do tipo AlX3. “X” corresponde a um halogênio, como o flúor ou o cloro. Veja um exemplo a seguir:
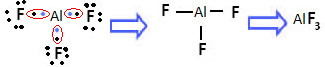
O trifluoreto de alumínio é um exemplo de contração do octeto
O alumínio ficou estável com apenas seis elétrons na camada de valência.
Mas visto que existem exceções à teoria do octeto, como é possível determinar a fórmula estrutural correta de um composto? Para tal, basta calcular a carga formal para as várias possibilidades de arranjos entre os átomos na formação de uma molécula. Aprenda como fazer isso por meio do texto Cálculo da carga formal.
Por Jennifer Fogaça
Graduada em Química
Videoaulas relacionadas: