Hibridização
Hibridização é um fenômeno em que orbitais atômicos incompletos unem-se permitindo a realização de um número maior de ligações covalentes por um átomo.
Por Diogo Lopes Dias
PUBLICIDADE
Hibridização é o nome do fenômeno que ocorre com o átomo de um determinado elemento químico, permitindo que ele realize um número maior de ligações covalentes ou que seja capaz de realizar essas ligações.
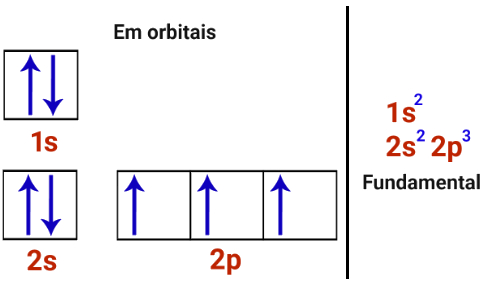
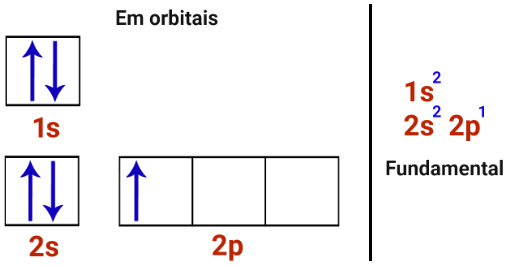
O número de ligações covalentes que um átomo realiza está relacionado com o número de orbitais incompletos que ele apresenta em sua camada de valência. Por exemplo, analise a distribuição eletrônica fundamental e em orbitais do elemento nitrogênio (cujo número atômico é 7):
Distribuições eletrônicas do nitrogênio
Observe que o nitrogênio possui três orbitais incompletos em sua camada de valência (2a camada), no subnível p, o que permite a ele realizar três ligações covalentes, pois, com mais três elétrons, sua camada de valência atingiria oito elétrons (de acordo com a teoria do octeto, já que havia cinco elétrons nessa camada).
Esse mesmo raciocínio pode ser aplicado avaliando apenas a família do elemento, de acordo com a tabela abaixo:
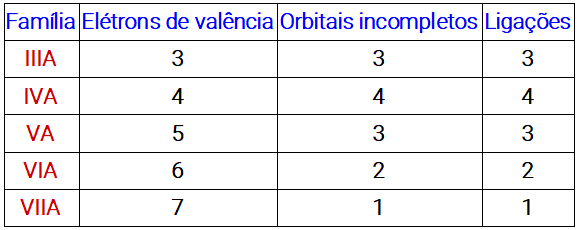
Tabela com o número de orbitais incompletos e o número de ligações
Essa realidade não se aplica a alguns elementos químicos, como é o caso do carbono, berílio e boro, os quais realizam ligações covalentes apenas após passarem pelo fenômeno da hibridização.
De uma forma geral, o fenômeno da hibridização ocorre na seguinte sequência:
-
O átomo recebe energia do meio externo;
-
Os elétrons dos orbitais mais externos absorvem essa energia;
-
Automaticamente, esses elétrons são excitados;
-
A tendência é que um elétron saia de um orbital completo e ocupe um orbital vazio;
-
Por fim, os orbitais incompletos unem-se.
Cada um desses passos podem ser observados nos casos a seguir:
Hibridização do berílio
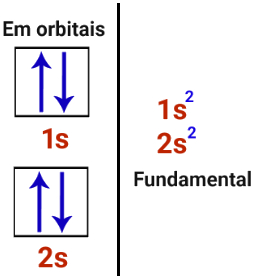
Distribuições eletrônicas do berílio
O berílio não apresenta orbital incompleto, logo não realizaria ligação, totalmente fora do contexto da teoria do octeto (não realizaria nenhuma ligação covalente). Porém, na prática, nas moléculas, o berílio sempre é encontrado realizando duas ligações, as quais ocorrem por causa do fenômeno da hibridização descrito a seguir:
-
1o Passo: Energia chega ao átomo de berílio.
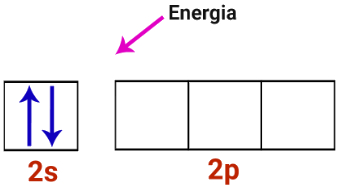
Camada de valência do átomo de berílio recebendo energia
-
2o Passo: Um elétron do subnível s da camada de valência excita-se e é transferido para um orbital vazio do subnível p.
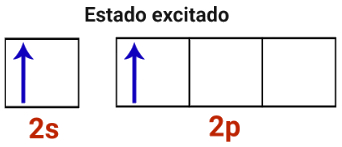
Representação do estado excitado de um átomo de berílio
-
3o Passo: O orbital incompleto do subnível s e o orbital do subnível p unem-se, constituindo o fenômeno da hibridização.
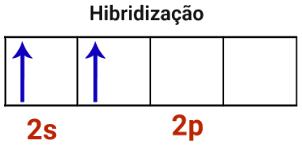
Representação da hibridização em átomo de berílio
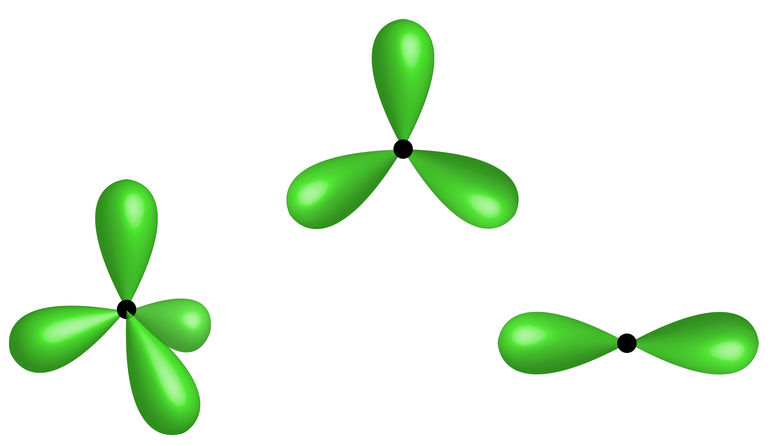
Como foram unidos um orbital s com um orbital p, a hibridização do átomo de berílio é do tipo sp.
Hibridização do boro
Distribuições eletrônicas do boro
O boro (número atômico: 5) apresenta apenas um orbital incompleto, por isso realizaria apenas uma ligação, totalmente fora do contexto da teoria do octeto. Porém, na prática, nas moléculas, o boro sempre é encontrado realizando três ligações, as quais ocorrem por causa do fenômeno da hibridização, conforme a seguir:
-
1o Passo: Energia chega ao átomo de boro.
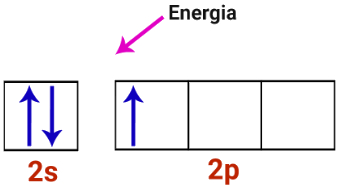
Camada de valência do átomo de boro recebendo energia
-
2o Passo: Um elétron do subnível s da camada de valência excita-se e é transferido para um orbital vazio do subnível p.
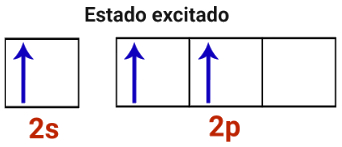
Representação do estado excitado de um átomo de boro
-
3o Passo: O orbital incompleto do subnível s e os dois orbitais do subnível p unem-se, constituindo o fenômeno da hibridização.
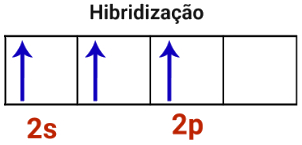
Representação da hibridização em átomo de boro
Como foram unidos um orbital s com dois orbitais p, a hibridização do átomo de boro é do tipo sp2.
Hibridização do carbono
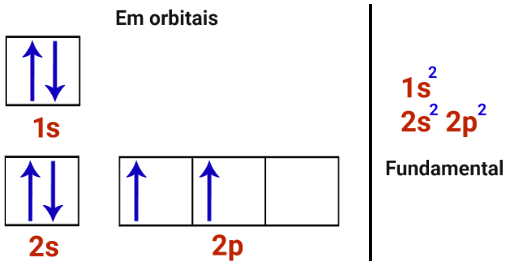
Distribuições eletrônicas do carbono
O carbono apresenta apenas dois orbitais incompletos, logo realizaria apenas duas ligações, totalmente fora do contexto da teoria do octeto. Porém, na prática, nas moléculas, o carbono sempre é encontrado realizando quatro ligações, as quais ocorrem por causa do fenômeno da hibridização descrito abaixo:
-
1o Passo: Energia chega ao átomo de carbono.
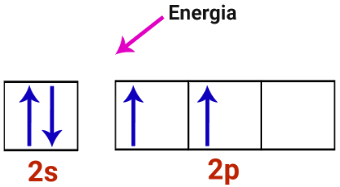
Camada de valência do átomo de carbono recebendo energia
-
2o Passo: Um elétron do subnível s da camada de valência excita-se e é transferido para um orbital vazio do subnível p.
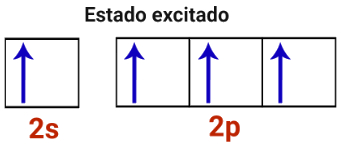
Representação do estado excitado de um átomo de carbono
-
3o Passo: O orbital incompleto do subnível s e os três orbitais do subnível p unem-se, constituindo o fenômeno da hibridização.
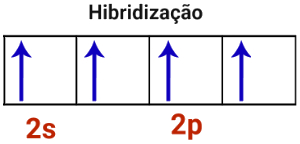
Representação da hibridização em átomo de carbono
Como foram unidos um orbital s com três orbitais p, a hibridização do átomo de carbono é do tipo sp3.
Outros elementos que sofrem o fenômeno da hibridização na natureza são: xenônio, enxofre, fósforo e telúrio.
Aproveite para conferir nossas videoaulas sobre o assunto: