Moléculas
Moléculas são formadas pela ligação covalente de átomos. São classificadas quanto ao número de átomos, à geometria e à polaridade, sendo identificadas pela fórmula molecular.
Por Stéfano Araújo Novais

PUBLICIDADE
As moléculas são formadas por meio da ligação covalente dos átomos e, por isso, também podem ser chamadas de compostos covalentes. Quando as moléculas interagem entre elas, por meio das interações intermoleculares, formam as substâncias que nós conhecemos do cotidiano.
Toda molécula pode ser representada por uma fórmula molecular. As moléculas podem ser classificadas de diversas formas, como quanto ao número de átomos presentes, de acordo com sua geometria ou de acordo com sua polaridade.
Leia também: Próton – segunda partícula subatômica a ser descoberta
Resumo sobre moléculas
-
A molécula é formada por meio da ligação covalente dos átomos.
-
Uma molécula pode ser formada por átomos do mesmo elemento químico (homonuclear) ou de elementos químicos diferentes (heteronuclear).
-
A ligação covalente é uma modalidade de ligação química em que os átomos compartilham elétrons.
-
A ligação química é formada por ametais, pois são espécies químicas que não possuem tendência a perder elétrons e que têm maior tendência a receber elétrons.
-
Uma molécula pode ser classificada quanto ao número de átomos presentes, quanto à geometria e quanto à polaridade.
-
Uma molécula pode ser representada graficamente por uma fórmula molecular, a qual contém o número de átomos presentes na molécula.
-
Moléculas e átomos são entidades diferentes, uma vez que os átomos são as unidades que deverão se ligar para que, então, formem-se as moléculas.
O que é molécula?
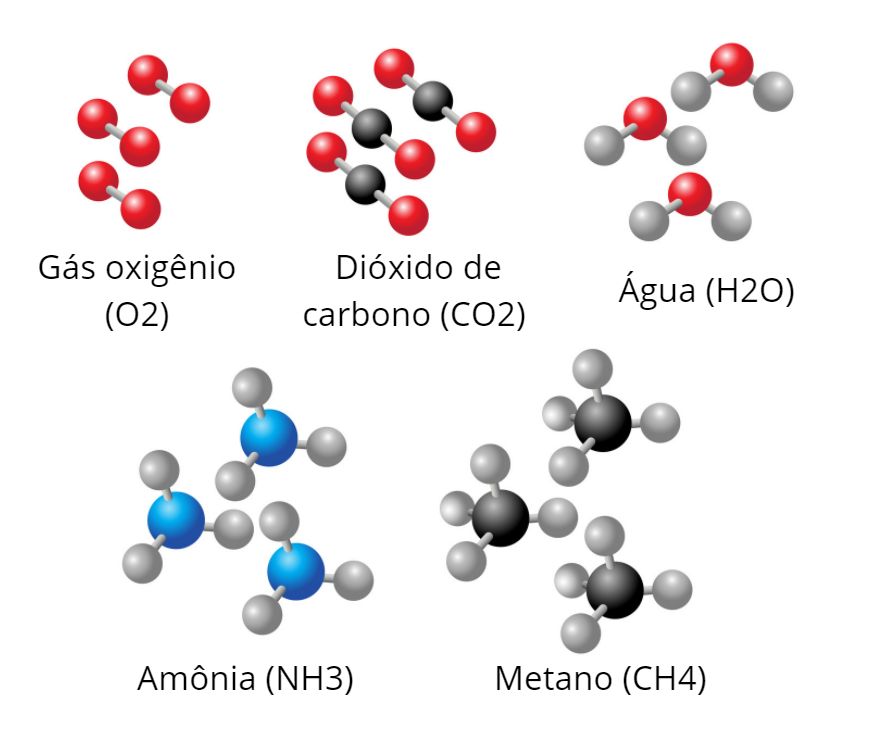
Uma molécula é um composto covalente, ou seja, formada por meio da ligação covalente de átomos. Se a molécula for formada por apenas um elemento químico, nós podemos dizer que ela é uma molécula homonuclear, a qual gerará uma substância simples, como é o caso das moléculas gasosas H2, N2 e O3; já se ela for formada por dois ou mais elementos químicos, nós podemos dizer que se trata de uma molécula heteronuclear, a qual gerará uma substância composta, como é o caso da água (H2O) e do dióxido de carbono (CO2).
Ligação covalente
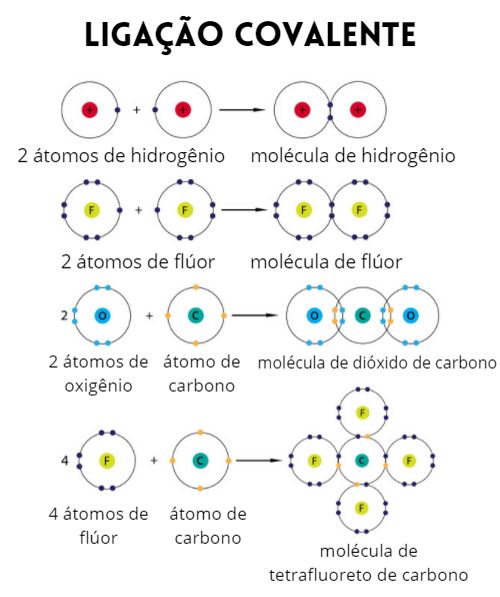
A ligação covalente é uma ligação química em que há o compartilhamento dos elétrons. Em geral, ela ocorre entre dois ametais, pois são espécies de alta energia de ionização, ou seja, não perdem elétrons com facilidade, e alta afinidade eletrônica, ou seja, estabilizam-se ao receberem um elétron na camada de valência.
Como os átomos envolvidos possuem propriedades semelhantes, a chave para que a ligação química seja estabelecida se dá por meio de um compartilhamento das nuvens eletrônicas, em que a nuvem é comum às duas espécies, o que quer dizer, em termos práticos, que podemos contabilizar os elétrons da nuvem compartilhada para os dois átomos.
Toda espécie química oriunda de uma ligação covalente é chamada de molécula.
-
Videoaula sobre ligação covalente
Tipos de moléculas
Na literatura encontramos várias formas de classificar moléculas, mas as principais são quanto ao número de átomos presentes, quanto à geometria molecular e quanto à polaridade.
-
Quanto ao número de átomos presentes
De acordo com o número de átomos presentes, classificamos a molécula utilizando os prefixos indicativos de quantidade di-, tri-, tetra-, e assim sucessivamente. Caso a molécula possua, por exemplo, dois átomos, pertencentes ao mesmo elemento químico (homonucleares) ou a elementos químicos diferentes (heteronucleares), ela será classificada como diatômica.
De modo semelhante, se ela possuir três átomos, independentemente de pertencerem ao mesmo elemento químico ou não, ela será classificada como triatômica. A tabela a seguir traz a classificação e exemplos para moléculas quanto ao número de átomos presentes.
|
Classificação |
Número de átomos presentes |
Exemplos |
|
Diatômica |
2 |
H2, HCl, CO |
|
Triatômica |
3 |
H2O, O3, HCN |
|
Tetratômica |
4 |
NH3, P4 |
|
Pentatômica |
5 |
CH4 |
Não há limites para o número de átomos em uma molécula, teoricamente. O enxofre, quando forma substância simples, por exemplo, é uma molécula octatômica, pois sua fórmula é S8. Já o fulereno, uma forma alotrópica do carbono, possui 60 átomos de carbono por molécula, sendo escrito como C60.
-
Quanto à geometria molecular
Toda molécula possui uma orientação espacial que lhe garante mais estabilidade, isso porque os ângulos que as ligações químicas estabelecem são importantes para minimizar os efeitos de repulsão eletrônica. Não se esqueça de que toda ligação química é feita de elétrons e que eles se repelem quando estão próximos.
A geometria adotada por uma molécula é aquela em que as ligações químicas têm a maior distância entre si em termos de ângulos. Deve-se lembrar, ainda, que alguns átomos não utilizam todos os seus elétrons da camada de valência para estabelecer ligações covalentes, os chamados elétrons não ligantes. Entretanto, como não deixam de ser elétrons, também impactam na repulsão entre cargas de mesmo sinal e, obviamente, devem ser considerados na hora de se predizer a geometria de cada molécula.
A tabela a seguir mostra as geometrias para diversas moléculas, de acordo com o número de átomos presentes na molécula, bem como se possuem ou não elétrons não ligantes no elemento central.
|
Número de átomos |
Geometria molecular |
Ângulo entre ligações |
Possui elétrons não ligantes? |
Exemplos |
|
2 |
Linear |
- |
Não |
H2, F2, HBr |
|
3 |
Linear |
180° |
Não |
CO2, BeH2 |
|
3 |
Angular |
Variável |
Sim |
H2O, SO2 |
|
4 |
Trigonal plana |
120° |
Não |
BF3 |
|
4 |
Piramidal |
Variável |
Sim |
NH3, PCl3 |
|
5 |
Tetraédrica |
109° 28’ |
Não |
CH4, SiH4 |
Veja também: Geometria piramidal – forma particular de geometria de uma molécula tetratômica
-
Quanto à polaridade
De extrema importância é também o conceito de polaridade da molécula. A polaridade de uma molécula prevê, por exemplo, se a substância gerada será solúvel em determinados solventes, como água ou querosene.
Em teoria, a polaridade é causada pelo acúmulo desigual de cargas elétricas em regiões distintas da molécula. Por exemplo, quando o hidrogênio se liga ao cloro, para formar o HCl, o cloro é sabidamente um átomo mais eletronegativo que o hidrogênio. Com isso, os elétrons da ligação entre esses dois átomos se localizam mais próximo ao cloro do que ao hidrogênio, criando-se uma polarização de cargas na molécula.
A polaridade das moléculas, além da eletronegatividade, é também dependente da geometria molecular. Por exemplo, vamos ver o caso do CO2.
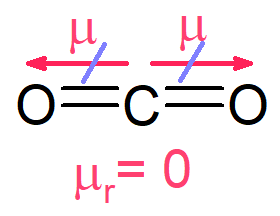
Os átomos de oxigênio são mais eletronegativos que o átomo central de carbono, dessa forma, os elétrons da ligação se localizam mais próximo aos átomos de oxigênio. Tal posicionamento dos elétrons é marcado pelo vetor momento dipolar, representado pela letra grega μ (mu, mas lê-se “mi”). Esse vetor tem função de orientar a polaridade da ligação, partindo da região positiva em direção à região negativa.
Contudo, como o dióxido de carbono é uma molécula linear, os vetores acabam tendo sentidos opostos, e, então, percebe-se que o vetor momento dipolar resultante (μr) é igual a zero. Quando isso ocorre, dizemos que a molécula é apolar.
Já no caso da água, a geometria faz com que ela seja polar, conforme vemos a seguir.
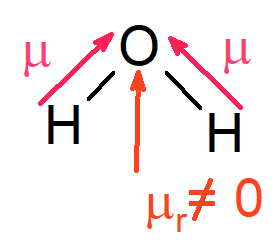
Os átomos de hidrogênio são menos eletronegativos que o átomo central de oxigênio, e, assim, os elétrons da ligação se localizam mais próximo ao oxigênio, conforme mostra os vetores momento dipolar. Entretanto, o somatório desses vetores gera um vetor resultando diferente de zero e, portanto, a molécula é considerada polar.
Sendo assim, podemos definir moléculas polares como aquelas que possuem vetor momento dipolar resultando diferente de zero, enquanto as moléculas apolares possuem vetor momento dipolar resultante igual a zero.
Diferença entre moléculas e átomos
Em geral, podemos dizer que toda molécula é feita de átomos, o que quer dizer que os átomos são diferentes das moléculas porque são eles que formam as moléculas.
Para que uma molécula surja, é necessário que dois ou mais átomos estabeleçam uma ligação covalente entre eles. Assim, quimicamente falando, átomos e moléculas estão em níveis diferentes.
Veja no exemplo a seguir para se ter mais noção do que estamos falando.
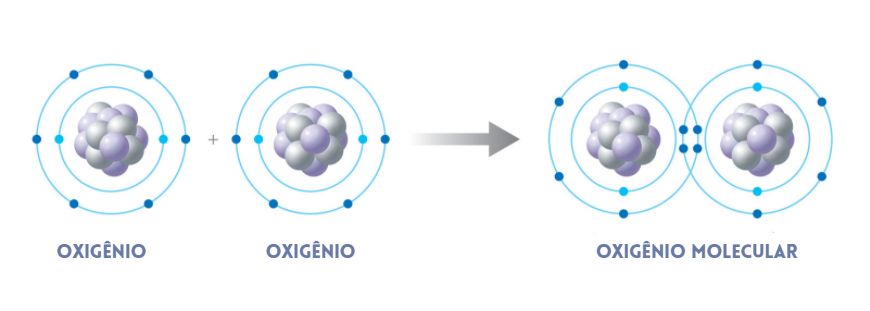
Como se vê na imagem, dois átomos de oxigênio (O) estão isolados e, então, estabelecem entre eles uma ligação covalente, formando a molécula de oxigênio, O2, também chamado de oxigênio molecular. Assim, átomos e moléculas são entidades diferentes, sendo as moléculas formadas por meio da ligação covalente dos átomos.
Fórmula molecular
Assim como átomos são representados por seus símbolos de elementos químicos, as moléculas também têm formas de serem representadas. Uma delas é a fórmula molecular, uma representação gráfica dos átomos participantes da molécula. A quantidade de átomos, também chamada de atomicidade, é representada sempre por números subscritos após o símbolo do respectivo elemento.
Por exemplo, a molécula de água é formada por dois átomos de hidrogênio e um átomo de oxigênio, assim, sua fórmula molecular é H2O. O cianeto de hidrogênio é formado por um átomo de hidrogênio, um de carbono e um de nitrogênio, possuindo fórmula molecular HCN.
Uma coisa que você deve ter percebido é que nas fórmulas moleculares o número 1 é sempre omitido, assim, não se escreve C1O2, mas sim CO2. Outro ponto de discussão é acerca da ordem que os elementos devem ser representados na fórmula molecular. Embora não haja uma regra oficial, há uma convenção de se representar os elementos em ordem crescente de eletronegatividade. Assim, embora seja possível entender que OH2 representa uma molécula com um átomo de oxigênio e dois átomos de hidrogênio, o mais indicado é colocar como H2O, uma vez que o hidrogênio possui menor eletronegatividade que o oxigênio.
Toda fórmula molecular é determinada empiricamente, ou seja, por meio de experimentos. Para isso, seguimos os três passos a seguir:
I. Descobrir quais elementos estão presentes.
II. Descobrir o percentual de massa de cada átomo na molécula.
III. Determinar a massa molecular.
Quando esses três passos são atingidos, chegamos à fórmula molecular.
Leia também: Quais são os principais tipos de fórmulas químicas?
-
Videoaula sobre fórmula molecular
Exercícios resolvidos
Questão 1 - (UERJ 2019) Novas tecnologias de embalagens visam a aumentar o prazo de validade dos alimentos, reduzindo sua deterioração e mantendo a qualidade do produto comercializado. Essas embalagens podem ser classificadas em Embalagens de Atmosfera Modificada Tradicionais (MAP) e Embalagens de Atmosfera Modificada em Equilíbrio (EMAP). As MAP são embalagens fechadas que podem utilizar em seu interior tanto gases como He, Ne, Ar e Kr quanto composições de CO2 e O2 em proporções adequadas. As EMAP também podem utilizar uma atmosfera modificada formada por CO2 e O2 e apresentam microperfurações na sua superfície, conforme ilustrado abaixo.

Adaptado de exclusive.multibriefs.com
Entre os gases citados no texto, aquele que corresponde a uma substância composta é simbolizado por:
A) Kr
B) O2
C) He
D) CO2
Resolução
Alternativa D. Uma substância composta é aquela originada de uma molécula heteronuclear. Como vimos no texto anterior, uma molécula heteronuclear é aquela que possui dois ou mais átomos de elementos químicos diferentes em sua composição.
Assim, a única alternativa que contém uma molécula heteronuclear é a alternativa D, CO2, uma vez que a fórmula molecular indica que essa molécula possui um átomo de carbono e dois átomos de oxigênio.
Questão 2 - (PUC-RJ 2020) O ácido tereftálico é um diácido carboxílico com fórmula molecular C8H6O4, muito utilizado na produção de poliéster do tipo PET (polietilenotereftalato).
O percentual mais aproximado em massa de carbono, hidrogênio e oxigênio no ácido tereftálico é
A) C: 44,5%; H: 33,3%; O: 22,2%
B) C: 57,8%; H: 3,6%; O: 38,6%
C) C: 33,3%; H: 33,3%; O: 33,3%
D) C: 51,3%; H: 9,2%; O: 39,5%
E) C: 64,0%; H: 4,2%; O: 31,8%
Dados: MC = 12 g.mol-1/ MH = 1 g.mol-1; MO = 16 g.mol-1
Resolução
Alternativa B
Observa-se que o ácido tereftálico possui fórmula molecular C8H6O4, ou seja, possui 8 átomos de carbono, 6 átomos de hidrogênio e 4 átomos de oxigênio.
Com base nessa fórmula molecular e nos dados informados na questão, podemos calcular sua massa molar:
MM = (8.MC) + (6.MH) + (4.MO) = (8.12) + (6.1) + (4.16) = 96 + 6 + 64 = 166 g.mol-1
Para se calcular o percentual, basta que se faça a razão entre a massa total de cada elemento sobre a massa total do composto, dada pela massa molar.
%C = (6.12)/166 = 96/166 = 0,578 = 57,8%
%H = (6.1)/166 = 6/166 = 0,036 = 3,6%
%O = (4.16)/166 = 64/166 = 0,386 = 38,6%
Com isso, podemos concluir que o gabarito é da letra B.