Ligação sigma
A ligação sigma é a interpenetração de orbitais atômicos em um mesmo eixo e pode ser classificada, de forma geral, em s-s, s-p ou p-p.
Por Diogo Lopes Dias
PUBLICIDADE
A ligação sigma é um dos dois casos particulares de ligação covalente ou molecular (o outro tipo é a ligação pi), no qual os orbitais – região do átomo em que há maior probabilidade de encontrar um elétron – dos átomos envolvidos interpenetram em um mesmo eixo, conforme as representações a seguir:
-
Penetração de dois orbitais pertencentes a um mesmo eixo horizontal:
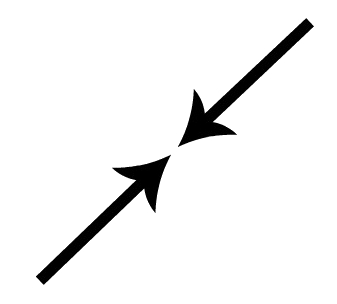
Representação por setas da penetração de orbitais no eixo horizontal.
-
Penetração de dois orbitais pertencentes a um mesmo eixo vertical:
Representação por setas da penetração de orbitais no eixo vertical.
-
Penetração de dois orbitais pertencentes a um mesmo eixo diagonal:
Representação por setas da penetração de orbitais no eixo diagonal.
Em uma estrutura química, as ligações sigmas podem ser reconhecidas da seguinte maneira:
-
Ligação simples (—): é uma ligação sigma;
-
Ligação dupla (=): apenas uma dessas ligações é sigma, a outra é ligação pi;
-
Ligação tripla (≡): apenas uma dessas três ligações é sigma, as outras são ligações pi.
Veja a seguir a explicação e a representação dos tipos de ligações sigma mais simples que ocorrem entre os átomos de moléculas.
Ligação sigma s-s
A ligação sigma s-s é realizada quando um orbital o tipo s interpenetra outro orbital do tipo s. Essa situação ocorre exclusivamente quando dois átomos de hidrogênio ligam-se para formar uma molécula de gás hidrogênio (H2).
![]()
Fórmula estrutural do gás hidrogênio
Cada orbital do tipo s é representado por uma esfera, e que cada um apresenta-se com um elétron desemparelhado.
Quando esses orbitais interpenetram, os elétrons passam a emparelhar-se:
.jpg)
Representação da interpenetração entre dois orbitais do tipo s Título: Interpenetração de orbitais s
O resultado dessa interpenetração entre os dois orbitais s é a formação de um único orbital, denominado orbital molecular s-s, que contém dois elétrons (esferas vermelhas).

Representação utilizada para o orbital molecular do tipo s-s
Ligação sigma p-p
A ligação sigma p-p acontece quando um orbital do tipo p interpenetra outro orbital do tipo p, situação essa que ocorre quando dois átomos, ametálicos e diferentes do hidrogênio, ligam-se para formar uma molécula.
Os elementos ametálicos que apresentam orbital p incompleto são: nitrogênio (N), fósforo (P), oxigênio (O), enxofre (S), selênio (Se), flúor (F), cloro (Cl), bromo (Br) e iodo (I). Um exemplo de molécula que apresenta ligação sigma p-p é a do gás cloro (Cl2).
![]()
Fórmula estrutural do gás cloro
Cada orbital do tipo p é representado por uma dupla-hélice, e cada uma está com um elétron desemparelhado.
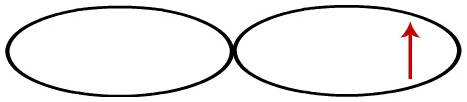
Representação dos orbitais p de cada átomo de cloro
Obs.: As duplas-hélices podem ser representadas ainda nos eixos vertical ou diagonal, porém, estando nesses eixos, como representado a seguir, não configuram ligação sigma e sim ligação do tipo pi.
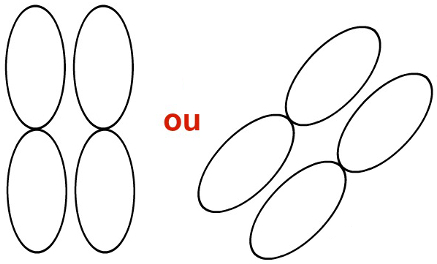
Representação dos orbitais p em sentidos diferentes (verticais e diagonais)
Quando os orbitais p interpenetram, os elétrons passam a emparelhar-se:
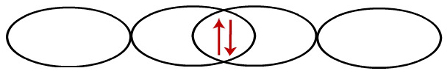
Representação da interpenetração entre dois orbitais do tipo p
O resultado dessa interpenetração entre os dois orbitais p é a formação de um único orbital, denominado orbital molecular p-p, que contém dois elétrons.
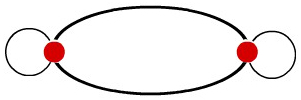
Representação utilizada para o orbital molecular do tipo p-p
Ligação sigma s-p
A ligação sigma s-p ocorre quando um orbital do tipo s interpenetra um orbital do tipo p. Essa situação acontece exclusivamente quando um átomo de hidrogênio liga-se com um elemento ametálico, como nitrogênio (N), fósforo (P), oxigênio (O), enxofre (S), selênio (Se), flúor (F), cloro (Cl), bromo (Br) e iodo (I).
Um exemplo de substância que apresenta a ligação sigma s-p é o ácido clorídrico (Hcl):
![]()
Fórmula estrutural do ácido clorídrico
Como já foi mencionado anteriormente, tanto o orbital s do hidrogênio quanto o orbital p do cloro apresentam um elétron. Quando esses orbitais interpenetram, os elétrons passam a emparelhar-se:
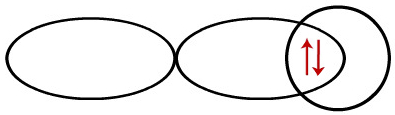
Representação da interpenetração entre orbitais do tipo s e p
O resultado dessa interpenetração entre os orbitais s e p é a formação de um único orbital, denominado orbital molecular s-p, que contém dois elétrons.
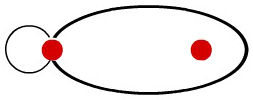
Representação utilizada para o orbital molecular do tipo s-p



.jpg)






