Classificação dos elementos na tabela periódica
A classificação dos elementos na tabela periódica é uma forma de organizá-los a fim de facilitar o estudo de suas características e propriedades.
Por Jhonilson Pereira Gonçalves

PUBLICIDADE
A classificação dos elementos na tabela periódica é baseada em suas propriedades atômicas, como número atômico, configuração eletrônica e propriedades químicas. Essa organização não só facilita a identificação e o estudo dos elementos como também permite prever como eles interagirão uns com os outros em diversas reações químicas.
A tabela funciona como uma ferramenta que agrupa todos os elementos químicos conhecidos de maneira que reflita suas propriedades e seus comportamentos. Já a classificação simplifica-a em grupos, períodos e blocos que ajudam a organizar os elementos de forma lógica e intuitiva, revelando padrões cruciais para a compreensão da Química moderna.
Leia também: Quantos e quais são os elementos químicos da tabela periódica?
Resumo sobre classificação dos elementos na tabela periódica
- Os elementos são organizados na tabela periódica em ordem crescente de número atômico.
- São distribuídos em sete períodos (linhas) e 18 grupos (colunas).
- Podem ser classificados, quanto à natureza física, em metais, ametais, metaloides (semimetais) e gases nobres.
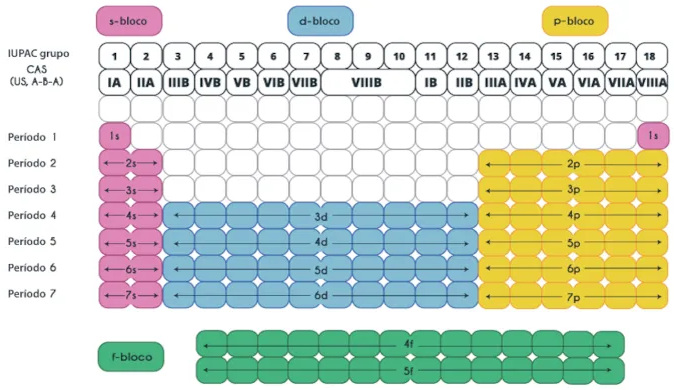
- Podem ser divididos em quatro blocos: s, p, d e f.
- Podem ser classificados em séries químicas, as quais remetem a grupos como: metais alcalinos, alcalinos-terrosos, grupos do boro, do carbono e do nitrogênio, calcogênios, halogênios e gases nobres.
- A classificação facilita o estudo e a previsão do comportamento dos elementos.
Videoaula sobre classificação dos elementos na tabela periódica
O que é a classificação periódica?
A classificação periódica é a organização dos elementos químicos em uma tabela, conhecida como tabela periódica, de forma que eles possam ser classificados de acordo com suas propriedades e características atômicas. Em outras palavras, é uma forma de organizar os elementos que apresentam um padrão de comportamento ao longo de um período ou grupo, permitindo, portanto, fazer-se previsões acerca das propriedades físicas e químicas deles.
Como são organizados os elementos na tabela periódica?
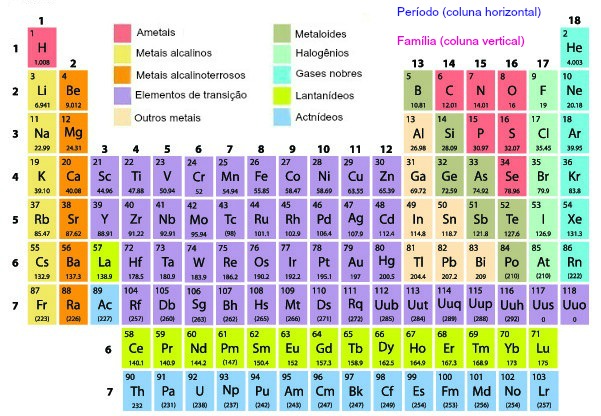
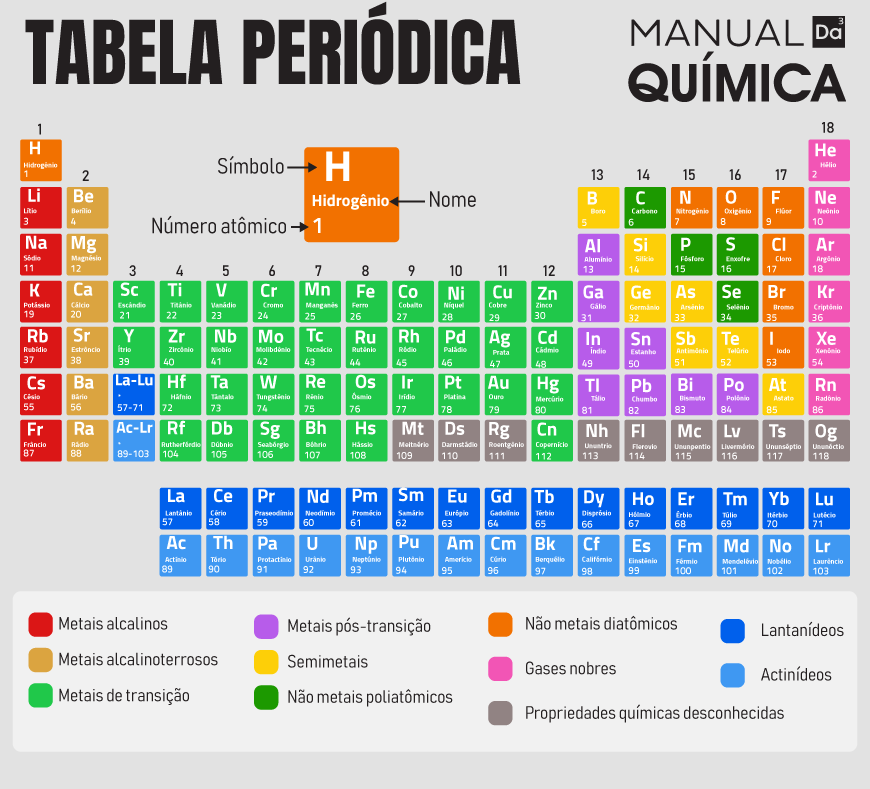
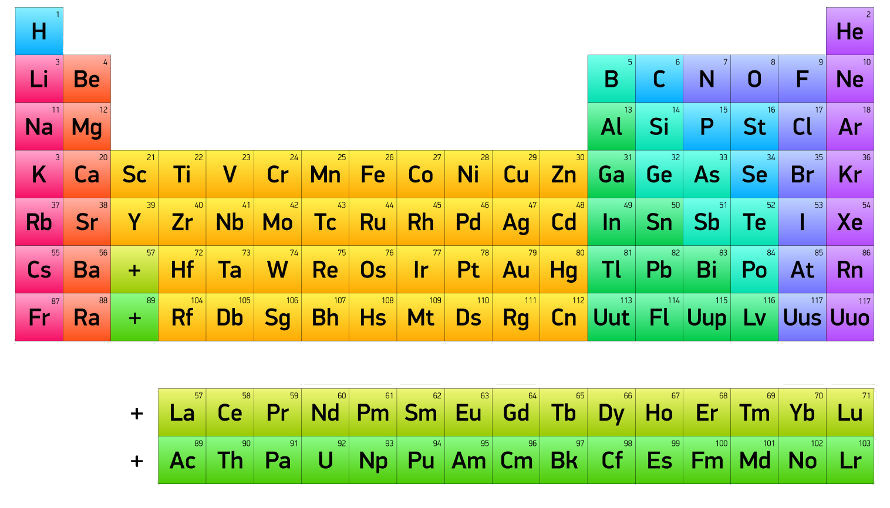
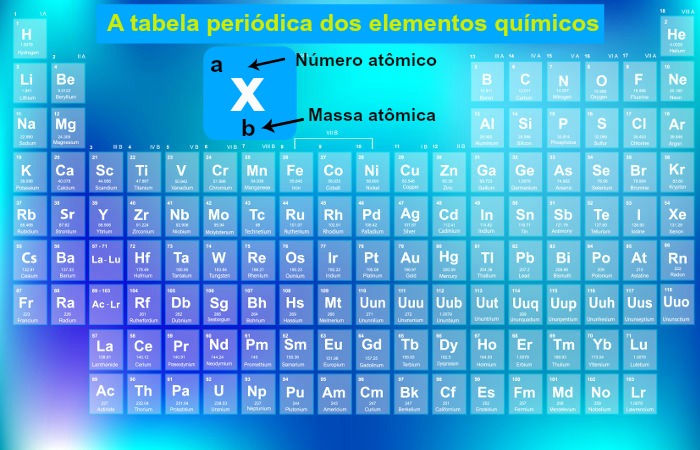
Na tabela periódica os elementos são organizados em ordem crescente de número atômico, que corresponde ao número de prótons no núcleo de cada átomo. Sendo assim, eles são dispostos em linhas horizontais, chamadas períodos, e em colunas verticais, chamadas grupos (anteriormente, famílias).
Cada período indica o número de camadas de elétrons que os átomos dos elementos têm, enquanto os grupos reúnem elementos com propriedades químicas semelhantes, como reatividade e estado físico, já que têm o mesmo número de elétrons na camada de valência. Diante disso, veja na tabela abaixo como é feita essa organização.
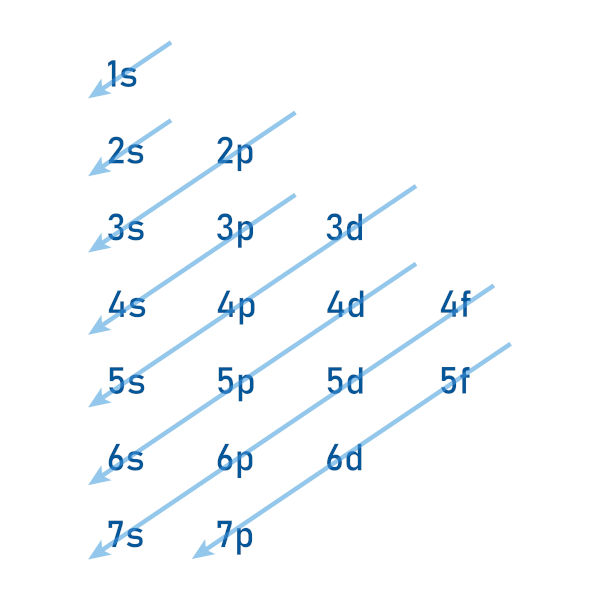
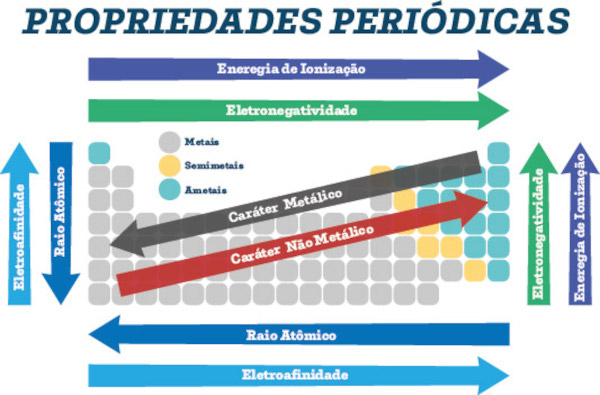
Além disso, a tabela é dividida em blocos (s, p, d, f), que correspondem ao subnível de energia onde se encontra o elétron mais energético dos elementos. Isso permite a identificação de tendências periódicas, como eletronegatividade, raio atômico e energia de ionização, que variam de forma previsível ao longo da tabela.
Veja também: Como é feita a distribuição eletrônica de um átomo
Qual a classificação dos elementos na tabela periódica?
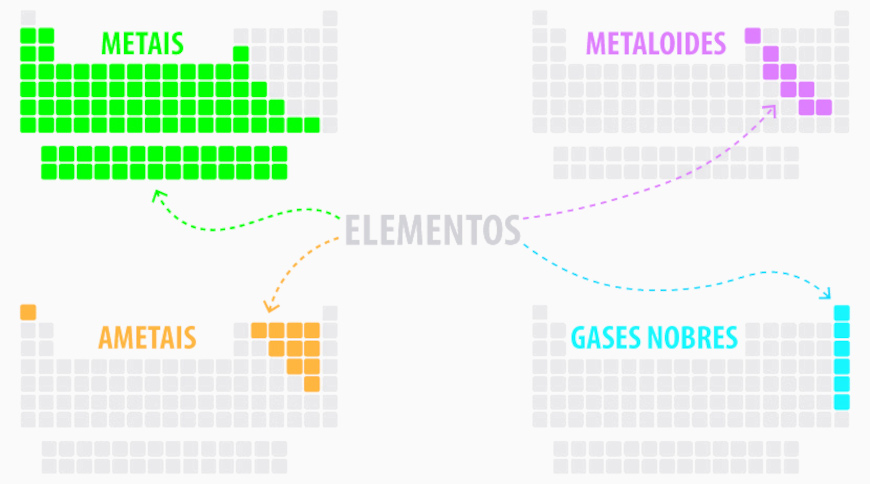
A classificação dos elementos na tabela periódica é feita com base em suas propriedades químicas e características atômicas, agrupando-os em categorias específicas da seguinte forma:
- Metais: ocupam a maior parte da tabela e estão localizados principalmente à esquerda e no centro. São geralmente bons condutores de calor e eletricidade, maleáveis, dúcteis e têm brilho metálico. Exemplos: ferro (Fe), ouro (Au) e alumínio (Al). Saiba mais sobre os metais clicando aqui.
- Ametais (ou não metais): encontram-se à direita da tabela periódica, exceto o hidrogênio, que está à esquerda. Eles não conduzem eletricidade e calor de maneira eficiente, são quebradiços quando sólidos e têm tendência a ganhar elétrons em reações químicas. Exemplos: oxigênio (O), enxofre (S) e carbono (C).
- Gases nobres: localizados no grupo 18 (antiga família 8A), são elementos que têm a camada de valência completa, o que os torna quimicamente inertes ou muito pouco reativos. Exemplos: (He), néon (Ne) e argônio (Ar). Saiba mais sobre os gases nobres clicando aqui.
- Metaloides (ou semimetais): têm propriedades intermediárias entre os metais e os ametais. Eles podem se comportar como condutores ou isolantes dependendo das condições. São encontrados ao longo da “escada” que separa metais e ametais. Exemplos: silício (Si) e germânio (Ge).
Além disso, alguns grupos recebem nomes específicos, como as séries dos elementos representativos, formados pelos grupos 1 e 2, e do 13 ao 18:
- Grupo 1 – metais alcalinos
- Grupo 2 – metais alcalinos terrosos
- Grupo 13 – grupo do boro
- Grupo 14 – grupo do carbono
- Grupo 15 – grupo do nitrogênio
- Grupo 16 – calcogênios
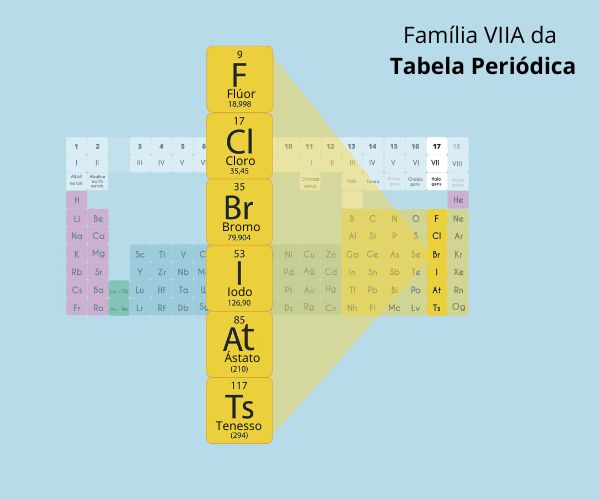
- Grupo 17 – halogênios
- Grupo 18 – gases nobres
Já do grupo 3 ao 12, temos os denominados metais de transição, que podem ser de transição interna ou externa, sendo estes últimos compostos pelas séries dos lantanídeos e actinídeos, localizados no sétimo período, e representados na parte externa da tabela, conforme é ilustrado abaixo:
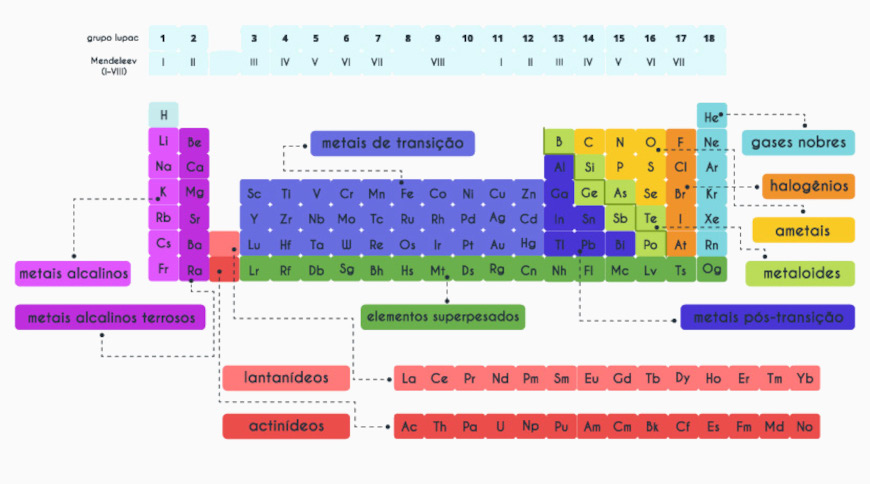
Essas são as principais classificações, mas, como pode-se notar, há algumas classificações adicionais advindas de atualizações recentes. Por exemplo, alguns metais são classificados como elementos superpesados, com número atômico superior a 104.
Por fim, temos também os elementos pós-transição, os metais localizados imediatamente após os metais de transição, e antes dos metaloides. Eles ocupam a parte inferior do bloco p da tabela e incluem elementos como alumínio (Al), gálio (Ga), índio (In), estanho (Sn), tálio (Tl), chumbo (Pb) e bismuto (Bi).
Saiba mais: Quais são os novos elementos da tabela periódica?
Exercícios resolvidos sobre a classificação dos elementos na tabela periódica
1. (Fatec) Leia o texto e a tabela para responder à questão.
Barcarena, no nordeste do Pará, é uma cidade da Amazônia marcada por desastres ambientais. Há semanas, depois de fortes chuvas, houve um vazamento de rejeitos em uma das empresas do polo industrial, o que contaminou rios da região. No município de Barcarena já houve outros registros de crimes ambientais de contaminação.
Em 2004, a Universidade Federal do Pará (UFPA) realizou uma pesquisa que concluiu que a água consumida pela população, em 26 localidades, estava contaminada por íons de metais pesados tais como Pb2+, Cd2+ e Hg2+, descartados pelas indústrias. Amostras de água de Vila Nova, Burajuba e do Distrito Industrial apresentaram concentração de chumbo 12 vezes maior que o máximo permitido por uma resolução de 2011 do Ministério da Saúde.
Acesso em: 06.03.2018. Adaptado
Tabela de padrão de potabilidade para algumas substâncias químicas que representam risco à saúde
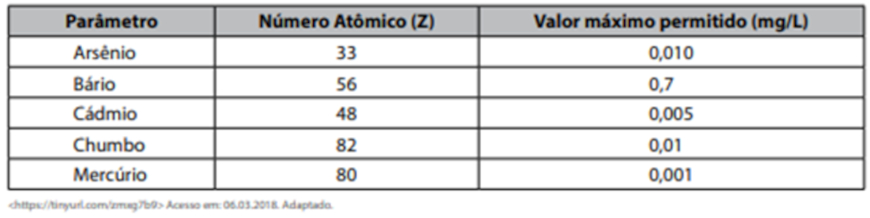
Assinale a alternativa correta.
Entre os elementos citados, o único pertencente ao grupo dos metais alcalino-terrosos é o
a) arsênio.
b) bário.
c) cádmio.
d) chumbo.
e) mercúrio.
Gabarito: b
Ao consultar a tabela periódica, o bário é o único, entre os elementos citados, que faz parte do grupo dos metais alcalinos-terrosos. Enquanto o cádmio e mercúrio pertencem aos metais de transição, o arsênio e o chumbo pertencem aos elementos representativos.
2. (Inep) A calagem é uma etapa do preparo do solo para o cultivo agrícola em que materiais de caráter básico são adicionados ao solo para neutralizar a sua acidez, corrigindo o pH desse solo. Os principais sais, adicionados ao solo na calagem, são o calcário e a cal virgem. O calcário é obtido pela moagem da rocha calcária, sendo composto por carbonato de cálcio (CaCO3) e/ou de magnésio (MgCO3). A cal virgem, por sua vez, é constituída de óxido de cálcio (CaO) e óxido de magnésio (MgO), sendo obtida pela queima completa (calcinação) do carbonato de cálcio (CaCO3).
(Fontes: Sítio https://alunosonline.uol.com.br/quimica/calagem.html e Sítio https://pt.wikipedia.org/wiki/Calagem. Acessados em 21/03/2017. Adaptados).
Os metais que aparecem no texto são classificados como
a) alcalinos.
b) halogênios.
c) calcogênios.
d) alcalinos-terrosos.
Gabarito: d
Os metais citados no texto são o magnésio e o cálcio, ambos fazem parte do grupo 2 na tabela periódica, também chamado de: metais alcalinos-terrosos.
Fontes
FELTRE, R. A classificação periódica dos elementos. In: Química Geral. 6. ed. São Paulo: Moderna, 2004. v. 1, p. 111–127.
L. BROWN, Theodore et al. Desenvolvimento da tabela periódica. In: Química: a ciência central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 272–273.
REIS, M. Tabela periódica. In: Química 1: Ensino Médio. 1aed. São Paulo: Editora Ática, 2013. v. 1, p. 200–220.