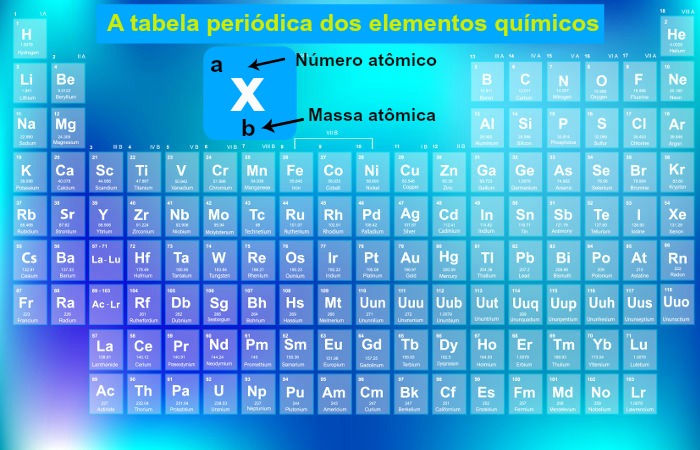
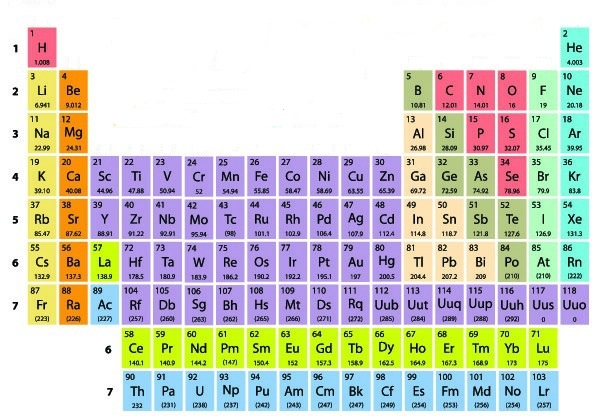
Famílias “A” da Tabela Periódica e sua distribuição eletrônica
As famílias “A” da Tabela Periódica e a distribuição eletrônica possuem relação importante, já que o subnível mais energético indica a família.
Por Diogo Lopes Dias

PUBLICIDADE
As famílias “A” da Tabela Periódica são os grupos 1, 2, 13, 14, 15, 16, 17 e 18, ou seja, as duas primeiras colunas verticais e as seis últimas colunas verticais existentes na Tabela. Elas são representadas e nomeadas da seguinte forma:
-
IA- Metais alcalinos
-
IIA- Metais alcalinoterrosos
-
IIIA- Família do boro
-
IVA- Família do carbono
-
VA - Família do nitrogênio
-
VIA- Calcogênios
-
VIIA - Halogênios
-
VIIIA - Gases nobres
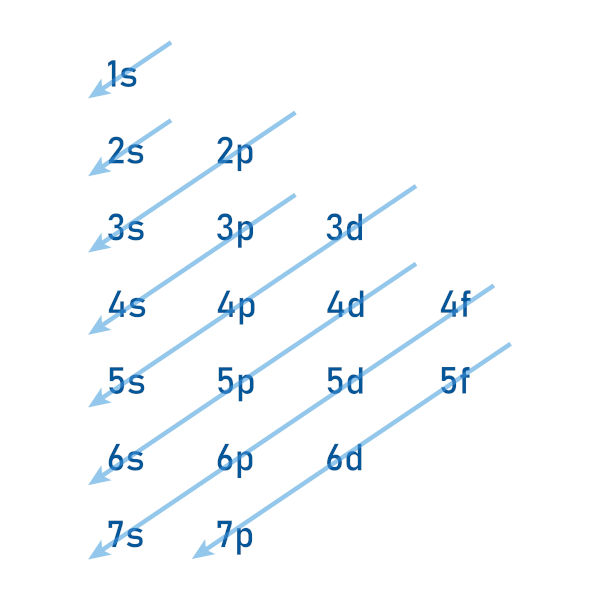
Neste texto, daremos ênfase na relação existente entre as famílias “A” da Tabela Periódica e a distribuição eletrônica. O item da distribuição eletrônica que está relacionado com uma família é o subnível mais energético, que é o último subnível a receber elétrons em uma distribuição. Por exemplo: na distribuição eletrônica do lítio, cujo número atômico é 3, o último subnível a receber elétrons é o 2s, por isso ele é o subnível mais energético. Veja a distribuição:
1s2
2s1
Os elementos das famílias “A” são chamados de representativos, e os subníveis mais energéticos que os representam sempre são o s ou o p. Vale ressaltar que no subnível s cabem, no máximo, dois elétrons, e no subnível p cabem seis elétrons. Quando somamos os dois elétrons do subnível s com os seis elétrons do p, temos um total de oito, valor que corresponde exatamente ao número de famílias “A”. Assim, cada uma das famílias A possui um subnível mais energético com uma quantidade particular de elétrons que representa a família, da seguinte forma:
-
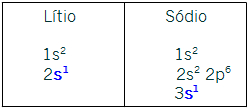
IA- s1. Todos os elementos dessa família possuem esse subnível como o mais energético. As distribuições dos representantes Lítio e Sódio confirmam esse fato:
-
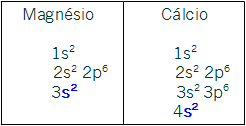
IIA- s2. Todos os elementos dessa família possuem esse subnível como o mais energético. As distribuições dos representantes Magnésio e Cálcio confirmam esse fato:
Não pare agora... Tem mais depois da publicidade ;)
-
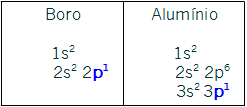
IIIA- p1. Todos os elementos dessa família possuem esse subnível como o mais energético. As distribuições dos representantes Boro e Alumínio confirmam esse fato:
-
IVA- p2. Todos os elementos dessa família possuem esse subnível como o mais energético. As distribuições dos representantes Carbono e Silício confirmam esse fato:

-
VA- p3. Todos os elementos dessa família possuem esse subnível como o mais energético. As distribuições dos representantes Nitrogênio e Fósforo confirmam esse fato:

-
VIA- p4. Todos os elementos dessa família possuem esse subnível como o mais energético. As distribuições dos representantes Oxigênio e Enxofre confirmam esse fato:

-
VIIA- p5. Todos os elementos dessa família possuem esse subnível como o mais energético. As distribuições dos representantes Flúor e Cloro confirmam esse fato:

-
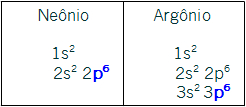
VIIIA- p6. Com exceção do elemento Hélio (pertencente ao primeiro período e que possui número atômico igual a dois, não sendo possível ter o subnível p como o mais energético), todos os outros elementos dessa família possuem esse subnível como o mais energético. As distribuições dos representantes Neônio e Argônio confirmam esse fato:
Observação: a distribuição eletrônica do Hélio é apenas 1s2. Ele é, portanto, o único elemento que não segue o padrão dos demais.
Por Me. Diogo Lopes Dias
Videoaulas relacionadas: