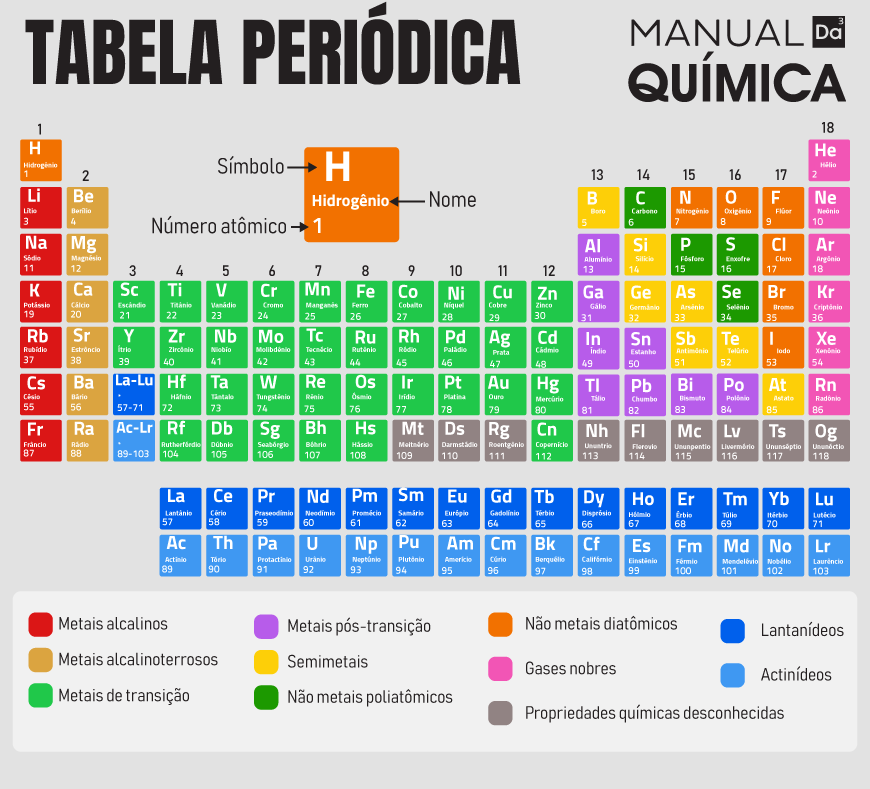
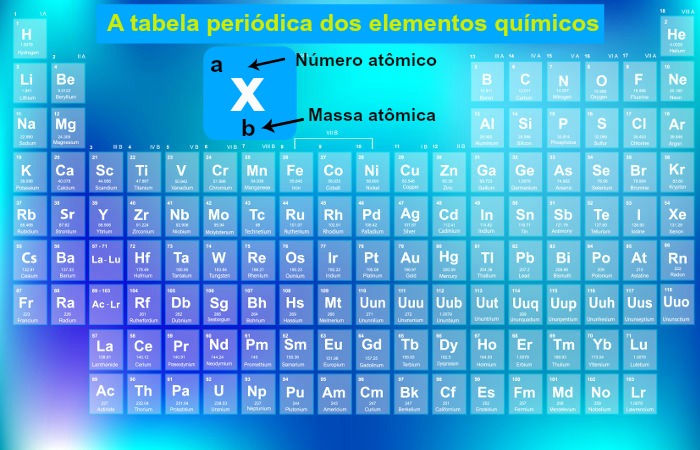
Períodos da Tabela Periódica
Os períodos da Tabela Periódica indicam a quantidade de níveis que os átomos de um determinado elemento químico apresentam.
Por Diogo Lopes Dias
PUBLICIDADE
A Tabela Periódica, ao ser proposta por Moseley em 1913, foi organizada com base em uma ordem crescente de número atômico dos elementos químicos, o que resultou em um padrão organizacional em forma de colunas horizontais e verticais. As verticais são denominadas de famílias ou grupos, e as horizontais são chamadas de períodos.
Neste texto, vamos dar ênfase apenas nos períodos da tabela periódica. Conhecer os períodos é o mesmo que conhecer a quantidade de níveis que qualquer átomo apresenta. Além de saber o número de níveis a partir dos períodos, é possível determinar a camada de valência do átomo.
Há sete períodos na Tabela Periódica, valor que representa a quantidade de níveis de energia que um átomo pode apresentar.
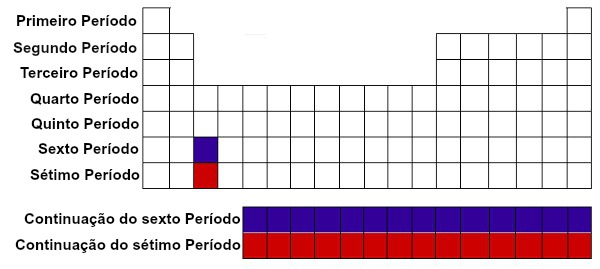
Demarcação dos períodos da tabela periódica
Vale ressaltar que a família IIIB apresenta um grande número de elementos no sexto (roxo) e sétimo (vermelho) períodos, chamados, respectivamente, de séries dos lantanídeos e série dos actinídeos.
Conhecendo o período que um determinado elemento ocupa na Tabela Periódica, não precisamos realizar uma distribuição eletrônica para identificar o número de níveis e a camada de valência do átomo.
Veja um esboço da Tabela Periódica que destaca alguns elementos químicos. Vamos conhecer então seus períodos, número de níveis e camada de valência:
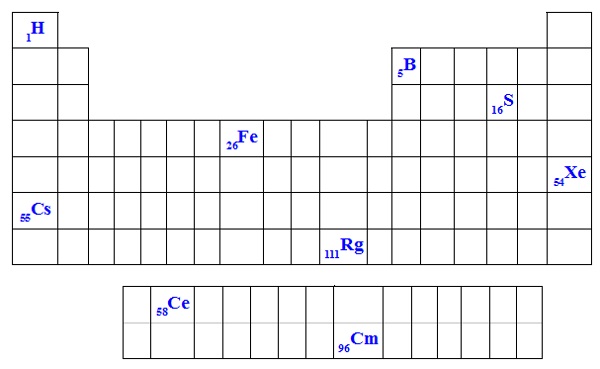
Elementos químicos em destaque na Tabela Periódica
Em cada um dos exemplos, vamos poder comparar as informações retiradas da tabela com a distribuição eletrônica de cada elemento.
a) Elemento Hidrogênio (H):
-
Está presente no 1o período;
-
Apresenta átomos com apenas 1 nível;
-
Sua camada de valência é a primeira.

Distribuição eletrônica com 1 nível
b) Elemento Boro (B):
-
Está presente no 2o período;
-
Apresenta átomos com apenas 2 níveis;
-
Sua camada de valência é a segunda.
Não pare agora... Tem mais depois da publicidade ;)
Distribuição eletrônica com 2 níveis
c) Elemento Enxofre (S):
-
Está presente no 3o período;
-
Apresenta átomos com apenas 3 níveis;
-
Sua camada de valência é a terceira.

Distribuição eletrônica com 3 níveis
d) Elemento Ferro (Fe):
-
Está presente no 4o período;
-
Apresenta átomos com apenas 4 níveis;
-
Sua camada de valência é a quarta.
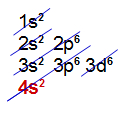
Distribuição eletrônica com 4 níveis
e) Elemento Xenônio (Xe):
-
Está presente no 5o período;
-
Apresenta átomos com 5 níveis;
-
Sua camada de valência é a quinta.
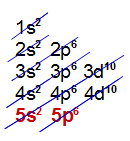
Distribuição eletrônica com 5 níveis
f) Elemento Césio (Cs):
-
Está presente no 6o período;
-
Apresenta átomos com 6 níveis;
-
Sua camada de valência é a sexta.
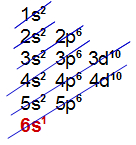
Distribuição eletrônica com 6 níveis
g) Elemento Cério (Ce):
-
Está presente no 6o período;
-
Apresenta átomos com 6 níveis;
-
Sua camada de valência é a sexta.
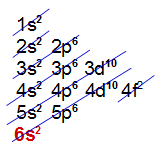
Distribuição eletrônica com 6 níveis
h) Elemento Roentgênio (Rg):
-
Está presente no 7o período;
-
Apresenta átomos com sete níveis;
-
Sua camada de valência é a sétima.

Distribuição eletrônica com sete níveis
i) Elemento Cúrio (Rg):
-
Está presente no 7o período;
-
Apresenta átomos com sete níveis;
-
Sua camada de valência é a sétima.

Distribuição eletrônica com 7 níveis
Por Me. Diogo Lopes Dias