Reações de dupla troca entre sal e base
As reações de dupla troca entre sal e base só ocorrem visualmente se houver a formação de sal ou base insolúvel ou, então, de hidróxido de amônio (NH4OH).
Por Diogo Lopes Dias

PUBLICIDADE
Uma reação de dupla troca é aquela em que o cátion (A) e o ânion (B) de uma substância associa-se com o ânion (D) e o cátion (C), respectivamente, de outra substância. Essa reação pode ser representada pela seguinte equação genérica:
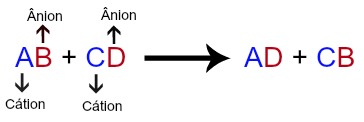
Equação genérica de uma reação de dupla troca
Assim, conhecendo um esquema geral de uma reação de dupla troca, fica fácil entender aquelas que ocorrem entre sais e bases. O sal apresenta como componentes um cátion (A) diferente do hidrônio (H+) e um ânion (B) diferente da hidroxila (OH-). Já a base apresenta um cátion (C) – na dupla troca, nunca o sal e a base possuem o mesmo cátion – diferente do hidrônio (H+) e um ânion hidroxila (OH-).
Então, em uma reação de dupla troca entre sal e base, o cátion A do sal interage com a hidroxila (OH-) da base, enquanto o cátion C da base interage com o ânion B do sal, como podemos observar na equação a seguir:
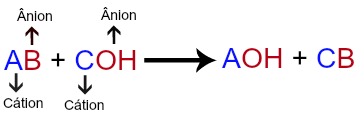
Equação geral de dupla troca entre sal e base
Visualmente (a olho nu), em laboratório, só se afirma que uma reação de dupla troca entre sal e base ocorreu se houver a formação de pelo menos um dos compostos abaixo:
-
Sal praticamente insolúvel (se é praticamente insolúvel, não se dissolve na água presente no sistema, ficando no fundo do recipiente ou na superfície de acordo com a sua densidade);
-
Base praticamente insolúvel (se é praticamente insolúvel, não se dissolve na água presente no sistema, ficando no fundo do recipiente ou na superfície de acordo com a sua densidade);
-
Hidróxido de amônio (NH4OH): trata-se de um composto instável que, ao se decompor, dá origem à água e ao gás amônia (NH3). Como há a presença do gás no sistema, percebemos a formação de bolhas no líquido reacional. Abaixo temos a equação que representa a decomposição do NH4OH:
NH4OH → H2O + NH3
Nos exemplos de equações de reações de dupla troca entre sal e base propostos a seguir, podemos verificar cada um dos critérios estudados acima:
a) Reação entre Iodeto de Potássio e Hidróxido de Alumínio
3 KI + Al(OH)3 → AlI3 + 3 KOH
Equação balanceada entre um iodeto e um hidróxido.
Título: Equação entre um iodeto e um hidróxido
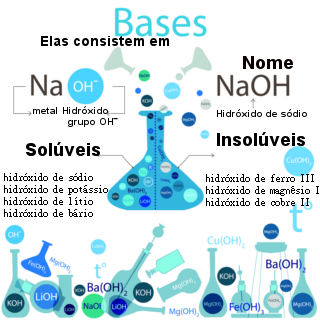
O K pertence à família IA (carga +1), e a hidroxila apresenta sempre carga -1. Como as cargas são iguais em número, a fórmula originada por elas é KOH. Trata-se de uma base solúvel, pois apresenta metal da família IA.
O Al pertence à família IIIA (carga +3) e o I pertence à família VIIA (carga -1); logo, a fórmula originada é AlI3, em razão do cruzamento das cargas.
Como o sal originado apresenta iodeto (I) não associado a Ag, Pb, Hg e Cu, trata-se de um sal solúvel. Além disso, como foram originados sal e base solúveis, a reação visualmente não acontece.
b) Reação entre Sulfato de Magnésio e Hidróxido de Titânio II
MgSO4 + Ti(OH)2→ TiSO4+ Mg(OH)2
O Mg pertence à família IIA (carga +2), e a hidroxila apresenta sempre carga -1. Como as cargas são diferentes, a fórmula é originada por um cruzamento das cargas, resultando no Mg(OH)2. Trata-se de uma base pouco solúvel porque apresenta metal da família IIA.
O Ti pertence à família IVB (tem carga +2, porque há 2 OH), e o SO4 possui carga-2. Como as cargas são iguais em valor, a fórmula originada é TiSO4, em razão do cruzamento.
Como o sal originado apresenta sulfato (SO4) não associado a Ag, Pb, Hg, trata-se de um sal solúvel. Além disso, foram originados sal e base pouco solúveis; logo, a reação visualmente não acontece.
c) Reação entre Fosfato de Cálcio e Hidróxido de Sódio
Ca3(PO4)2 + 6 NaOH→ 2 Na3PO4+ 3 Ca(OH)2
O Ca pertence à família IIA (carga +2), e a hidroxila apresenta sempre carga -1. Como as cargas são diferentes, a fórmula é originada por um cruzamento das cargas, resultando no Ca(OH)2. Trata-se de uma base pouco solúvel, pois apresenta metal da família IIA.
O Na pertence à família IA (carga +1), e o PO4 possui carga-3. A fórmula é originada por um cruzamento das cargas, que são diferentes em valor, o que resulta no Na3PO4.
Como o sal originado apresenta fosfato associado a elemento da família IA, trata-se de um sal solúvel. Foram originados sal solúvel e base pouco solúvel; logo, a reação visualmente não acontece.
d) Reação entre dicromato de potássio e o hidróxido de cobre II
K2Cr2O7 + Cu(OH)2→ CuCr2O7 + 2 KOH
O K pertence à família IA (carga +1), e a hidroxila apresenta sempre carga -1. Como as cargas são iguais em número, a fórmula originada por elas é KOH. Trata-se de uma base pouco solúvel, pois apresenta metal da família IA.
O Cu pertence à família IB (apresenta carga +2 porque há 2 OH), e o Cr2O7 possui carga-2. A fórmula originada é CuCr2O7 em virtude do cruzamento das cargas, que são iguais em valor.
Como o sal originado apresenta dicromato (Cr2O7 ) não associado a NH4 e nenhum elemento da IA, trata-se de um sal insolúvel. Além disso, como foram originados sal insolúvel e base solúvel, a reação visualmente acontece.
e) Reação entre Nitrato de prata e o Hidróxido de ferro III
3 AgNO3 + Fe(OH)3→ Fe(NO3)3+ 3 AgOH
O Ag pertence à família IB (carga +1), e a hidroxila apresenta sempre carga -1. Como as cargas são iguais em número, a fórmula originada por elas é AgOH. Trata-se de uma base praticamente insolúvel, pois não apresenta metal da família IA.
O Fe pertence à família VIIIB (tem carga +3 porque há 3 OH), e o NO3 possui carga-1. A fórmula originada é Fe(NO3)3, em virtude do cruzamento das cargas, que são diferentes em valor.
Como o sal originado apresenta nitrato (NO3), ele é solúvel, pois todos os sais com nitrato são solúveis. A reação não ocorre visualmente porque foram originados sal solúvel e base praticamente insolúvel.
Por Me. Diogo Lopes Dias