Ácido sulfúrico
O ácido sulfúrico é um ácido forte, extremamente corrosivo e oxidante. É considerado uma das substâncias mais produzidas no mundo.
Por Victor Ricardo Ferreira

PUBLICIDADE
O ácido sulfúrico é um ácido inorgânico líquido na temperatura ambiente, incolor, viscoso e pouco volátil, ou seja, não evapora com facilidade. Sua temperatura de fusão é de 10,4°C e de ebulição 337°C. Sua densidade é 1,84 g/cm3.
É uma substância muito solúvel em água, mas esse processo de mistura deve ser feito com muita cautela, sempre adicionando o ácido sulfúrico na água e nunca ao contrário, pois é uma mistura que libera muito calor e gera desprendimento de gases que podem causar graves acidentes.
Leia também: Força dos ácidos e seu grau de ionização
Fórmula do ácido sulfúrico
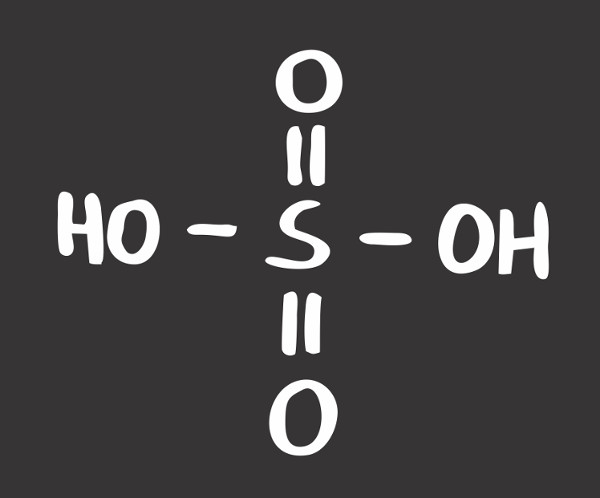
O ácido sulfúrico possui fórmula molecular H2SO4 e massa molar 98,08 g/mol. Os átomos de enxofre, oxigênio e hidrogênio são unidos por ligações covalentes com compartilhamento de elétrons. O ácido sulfúrico é considerado um ácido forte e uma substância bastante oxidante, corrosiva e desidratante, mesmo em concentrações moderadas.
Usos do ácido sulfúrico
O ácido sulfúrico é uma das substâncias com maiores utilizações nas indústrias, pois esse ácido está diretamente ligado aos processos industriais mais comuns da indústria química, como na produção de fertilizantes (um dos produtos mais utilizados mundialmente), em que o ácido sulfúrico é uma das matérias-primas usadas no processo. Para se ter ideia, cerca de 60% do ácido sulfúrico produzido no mundo é destinado para a indústria de fertilizantes.
O ácido sulfúrico também é usado na composição de baterias automotivas, servindo como eletrólito, que é uma solução que permite a passagem de corrente elétrica pelo sistema da bateria. O ácido sulfúrico é um bom eletrólito, pois é uma substância com alto grau de ionização, ou seja, ioniza-se com grande facilidade, tornando-se um excelente condutor de eletricidade.
Além disso, o ácido sulfúrico também é utilizado na fabricação de explosivos, papéis, tintas, no processo de refino do petróleo e atua como catalisador de diversas reações químicas em processos laboratoriais.
Veja também: Propriedades e aplicações do ácido acético
Produção industrial do ácido sulfúrico

O ácido sulfúrico é produzido em escala industrial pelo método denominado processo de contato, que acontece em três etapas:
1ª etapa: Queima do enxofre para produção de dióxido de enxofre
S(s) + O2(g) → SO2(g)
2ª etapa: Oxidação do dióxido de enxofre a trióxido de enxofre
2 SO2(g) + O2(g) ![]() 2 SO3(g)
2 SO3(g)
3ª etapa: Hidratação do trióxido de enxofre, formando o ácido sulfúrico
SO3(g) + H2O(l) → H2SO4(l)
Saiba também: Como ocorrem as reações com óxidos ácidos?
Onde é encontrado o ácido sulfúrico?
Além dos usos e aplicações do ácido sulfúrico listados anteriormente, o ácido sulfúrico pode ser encontrado na chuva ácida. Ela é formada pela reação de óxidos de enxofre liberados da queima de combustíveis fósseis, nos grandes centros urbanos, e a água, como é mostrado na reação a seguir.
SO2 (g) + ½ O2 (g) → SO3 (g)
SO3 (g) + H2O (l) → H2SO4 (aq)
Nessa reação, o dióxido de enxofre sofre oxidação na atmosfera e forma o trióxido de enxofre, que em seguida reage com a água e forma o ácido sulfúrico.
O ácido sulfúrico também é formado, em taxas menores, de forma natural pela oxidação de sulfetos presentes em minérios, como a galena (sulfeto de chumbo II), a pirita (sulfeto de ferro II), esfarelita (sulfeto de zinco), entre outros. Esses sulfetos também são liberados como produtos das atividades vulcânicas, podendo resultar na formação de ácido sulfúrico.