Produto de solubilidade
O produto de solubilidade é a multiplicação das concentrações molares dos íons liberados na dissociação de um eletrólito pouco solúvel em água.
Por Diogo Lopes Dias

PUBLICIDADE
Produto de solubilidade, ou constante do produto de solubilidade, (Kps) é a multiplicação (produto) entre as concentrações molares dos íons (cátions e ânions), produzidos ou liberados por um eletrólito qualquer (por exemplo, base e sal), de baixa solubilidade, quando é adicionado à água.
Base pouco solúvel: formada por elementos da família IIA ou metais alcalinoterrosos;
Base praticamente insolúvel: formada por qualquer metal que não pertença à família IA ou metais alcalinos;
- Sais praticamente insolúveis (verificar tabela abaixo).
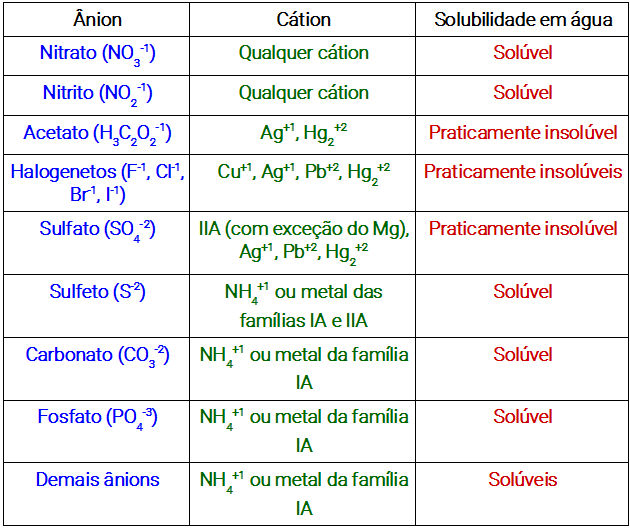
Tabela de solubilidade dos sais
Quando um eletrólito é adicionado à água, independentemente se a solubilidade é alta ou baixa, ocorre a sua dissociação (liberação de íons) ou ionização (produção de íons). Porém, ao mesmo tempo, esses íons voltam a formar o eletrólito, ocorrendo um equilíbrio químico de dissolução.
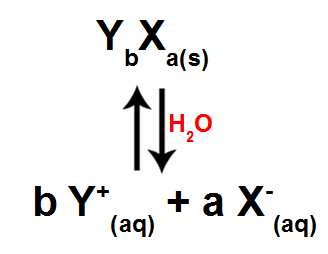
Equilíbrio químico de dissolução de um eletrólito qualquer
Quando o sulfato de bário é adicionado à água, por exemplo, como é um sal de pouca solubilidade, poucos íons são liberados.
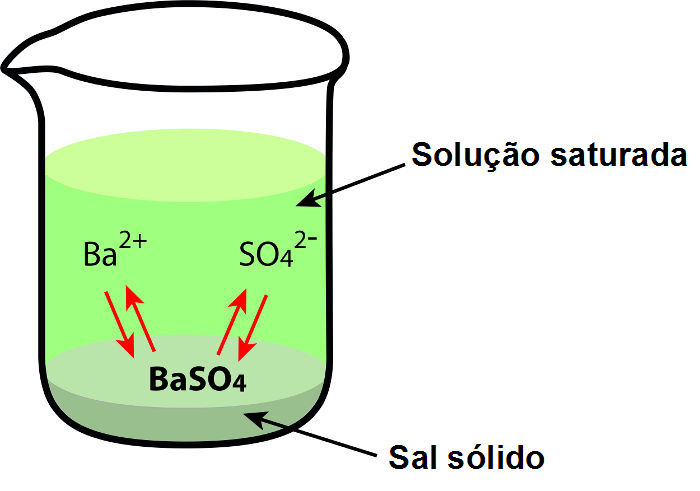
Representação da dissolução do BaSO4 em água
Entretanto, como há liberação de íons, logo ocorre o equilíbrio de dissolução.
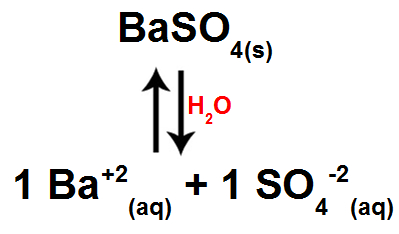
Equilíbrio de dissolução do sulfato de bário
Como a adição de um eletrólito à água é obrigatória para que haja o equilíbrio de dissolução, eletrólito e água são, portanto, substâncias constantes, pois elas jamais entram na expressão da constante desse equilíbrio.
A expressão matemática para calcular a constante do produto de solubilidade sempre usa a concentração molar de cada íon, elevada às suas respectivas quantidades molares:
Kps = [Y+]b.[X-]a
A expressão da constante do produto de solubilidade para o sulfato de bário, de acordo com o exposto anteriormente, seria:
Kps = [Ba+2]1.[SO4-2]1
Obs.: A partir da análise da constante do produto de solubilidade, é possível determinar a classificação de uma solução em saturada, insaturada ou saturada com corpo de fundo. Essa análise sempre relaciona o produto da solubilidade com o Kps.
- Se o produto de solubilidade for menor ao valor do Kps, a solução será insaturada.
- Se o produto de solubilidade for igual ao valor do Kps, a solução será saturada.
- Se o produto de solubilidade for maior ao valor do Kps, a solução será saturada com corpo de fundo.








