Energia de ligação
A energia de ligação é a energia necessária para romper uma ligação química específica.
Por Stéfano Araújo Novais

PUBLICIDADE
Energia de ligação é a energia necessária para se romper uma ligação química específica sob pressão constante. Nesse caso, a energia da ligação pode ser medida por meio da entalpia de ligação. Todo rompimento de uma ligação química é um processo endotérmico e, por conta disso, a formação da ligação (que é o processo contrário) é um processo exotérmico.
A energia de ligação pode ser utilizada para determinar a entalpia da reação química, por meio da avaliação das ligações químicas que foram rompidas ou formadas ao longo do processo químico. Com isso, podemos utilizar as energias das ligações para determinação da variação total da quantidade de calor transferida em uma reação química.
Leia também: Entropia — o que é e como calcular
Resumo sobre energia de ligação
- A energia de ligação é a energia necessária para romper uma ligação química específica sob pressão constante.
- A energia de ligação pode ser medida por meio da entalpia de ligação.
- O rompimento de uma ligação química é um processo endotérmico e, por conta disso, entende-se que a formação de uma ligação química é um processo exotérmico.
- A energia de ligação pode ser utilizada para determinar a variação de entalpia de uma reação química.
Videoaula sobre energia de ligação
O que é energia de ligação?
A energia de uma ligação química é a energia necessária para se romper uma ligação química específica sob pressão constante. Por conta disso, a energia de ligação é medida por meio da entalpia de ligação.
O único ponto que sempre deve ser observadod é de que a quebra de uma ligação química é um processo endotérmico, pois a molécula precisa absorver energia, na forma de calor, para então romper essa ligação. Dessa forma, a entalpia de ligação para a quebra da ligação H−H no H2 é:
H2 (g) → 2 H (g) ΔH = +436 kJ/mol
Como o processo de formação da ligação química é o inverso da quebra da ligação, então a entalpia de ligação para a formação de uma ligação é exotérmica. Isso faz sentido, uma vez que a formação da ligação química traz mais estabilidade para os átomos, ocasionando perda de energia. Dessa forma, na formação do H2, temos que:
2 H (g) → H2 (g) ΔH = −436 kJ/mol
Qual a fórmula da energia de ligação?
Em uma reação química, admitimos que as ligações químicas dos reagentes são quebradas para que novas ligações químicas nos produtos sejam formadas. Dessa forma, é possível usar as energias de ligação (por meio das entalpias de ligação) para determinar a variação total da quantidade de calor transferida no processo químico, ou seja, para determinar a variação de entalpia de uma reação.
Nesse caso, a variação da entalpia da reação será determinada por um balanço energético das ligações químicas que forem quebradas e formadas:
\(\Delta H = \sum(\Delta H_{rompidas} + \Delta H_{formadas})\)
Cálculo da energia de ligação
Para o cálculo da variação de entalpia da reação por meio das energias de ligação, devemos apenas levar em consideração duas coisas:
- atribuir corretamente o sinal de positivo ou negativo para a energia de ligação, pensando se a ligação está sendo formada ou rompida;
- considerar, para simplicidade do cálculo, apenas as ligações que são, de fato, rompidas ou formadas.
Vejamos o caso da reação de hidratação do propeno (C3H6):
C3H6 (g) + H2O (g) → C3H8O (g)
Para avaliarmos as ligações que foram rompidas e formadas, devemos observar as fórmulas estruturais das substâncias envolvidas no processo reacional:
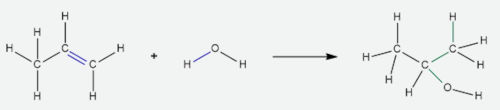
Em azul, nos reagentes, estão as ligações rompidas, ou seja:
- 1 mol de ligação C=C, o que equivale a +612 kJ;
- 1 mol de ligação O−H, o que equivale a +463 kJ.
Isso totaliza +1075 kJ de energia necessários para o rompimento das ligações dos reagentes.
Já em verde, nos produtos, estão as ligações que foram formadas, ou seja:
- 1 mol de ligação C−C, o que equivale a −348 kJ;
- 1 mol de ligação C−O, o que equivale a −360 kJ;
- 1 mol de ligação C−H, o que equivale a −412 kJ.
Isso totaliza −1120 kJ de energia liberadas na formação das ligações dos produtos.
Assim, a variação de entalpia para a reação é:
ΔH = +1075 + (−1120)
ΔH = +1075 − 1120
ΔH = −45 kJ
Tabela de energia de ligação
|
Ligação |
Energia de ligação (kJ/mol) |
|
H−H |
436 |
|
H−F |
565 |
|
H−Cl |
431 |
|
H−Br |
366 |
|
H−I |
299 |
|
C−C |
348 |
|
C=C |
612 |
|
C≡C |
837 |
|
C−O |
360 |
|
C=O |
743 |
|
C−N |
305 |
|
C−F |
484 |
|
C−Cl |
338 |
|
C−Br |
276 |
|
C−I |
238 |
|
N−H |
388 |
|
N−N |
163 |
|
N=N |
409 |
|
N≡N |
944 |
|
N−O |
210 |
|
N=O |
630 |
|
N−F |
270 |
|
N−Cl |
200 |
|
O=O |
496 |
|
O−O |
157 |
|
O−H |
463 |
|
F−F |
158 |
|
Cl−Cl |
242 |
|
Br−Br |
193 |
|
I−I |
151 |
Leia também: Quais são os tipos de entalpia?
Exercícios resolvidos sobre energia de ligação
Questão 1
(UnB Conhecimentos Gerais/2025.3) O gás hidrogênio é bastante utilizado como combustível para a propulsão de foguetes espaciais. A reação de combustão pode ser representada pela equação não balanceada a seguir.
H2 (g) + O2 (g) ⇌ H2O (g)
Valores de entalpia de ligação (H°lig)
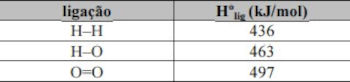
Considerando as informações presentes no texto e na tabela precedentes, julgue o item que se segue.
A reação de combustão do gás hidrogênio libera uma quantidade de energia superior a 230 kJ/mol.
( ) Certo
( ) Errado
Resposta: Certo.
Para essa reação, antes de mais nada, devemos fazer o balanceamento:
H2 (g) + ½ O2 (g) ⇌ H2O (g)
Em termos de fórmulas estruturais, temos:
H−H + ½O=O → H−O−H
Portanto, percebemos a quebra de:
- 1 mol de ligação H−H: +436 kJ;
- ½ mol de ligação O=O: ½ (+497) = +248,5;
Totalizando, assim, +684,5 kJ de energia.
Assim como percebemos a formação de:
- 2 mols de ligação H−O: 2(−463) = −926 kJ.
A variação de entalpia para um mol de H2 é igual a:
ΔH = +684,5 + (−926)
ΔH = −241,5 kJ/mol de H2
Que é uma quantidade liberada superior aos 230 kJ/mol.
Questão 2
(Unesp Conhecimentos Gerais/2025.1) A hidrazina (N2H4), substância utilizada como propelente de foguetes, sofre combustão conforme a equação:
N2H4 + O2 ⟶ N2 + 2 H2O
A tabela apresenta alguns valores de entalpias de ligação envolvidas nessa reação.
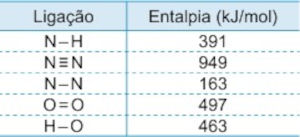
Utilizando os dados tabelados, calcula-se que a combustão de 1 mol de hidrazina irá liberar
- 949 kJ.
- 1 727 kJ.
- 577 kJ.
- 2 224 kJ.
- 2 801 kJ.
Resposta: Letra C
A reação em termos de fórmulas estruturais é:

Como é possível perceber, todas as ligações deverão ser rompidas e formadas no processo. Assim, são rompidas:
- 4 mols de ligação N−H: 4(+391) = +1564 kJ;
- 1 mol de ligação N−N: +163 kJ;
- 1 mol de ligação O=O: +497 kJ.
Totalizando: +2224 kJ;
E são formadas:
- 1 mol de ligação N≡N: −949 kJ;
- 4 mols de ligação H−O: 4(−463) = −1852 kJ.
Totalizando: −2801 kJ
A variação de entalpia para o processo descrito é:
ΔH = +2224 + (−2801)
ΔH = −577 kJ/mol N2H4
Fontes:
ATKINS, P.; DE PAULA, J.; KEELER, J. Physical Chemistry. 11. ed. Oxford: Oxford University Press, 2018.
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
CASTELLAN, G. Fundamentos de Físico-Química. 1. ed. Barueri: LTC Editora, 1986.