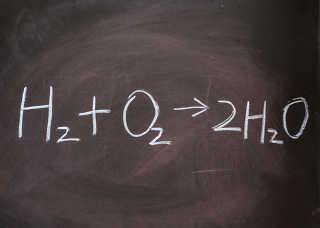Balanceamento químico
O balanceamento químico é uma técnica que busca igualar os participantes em ambos os lados de uma equação química.
Por Stéfano Araújo Novais
PUBLICIDADE
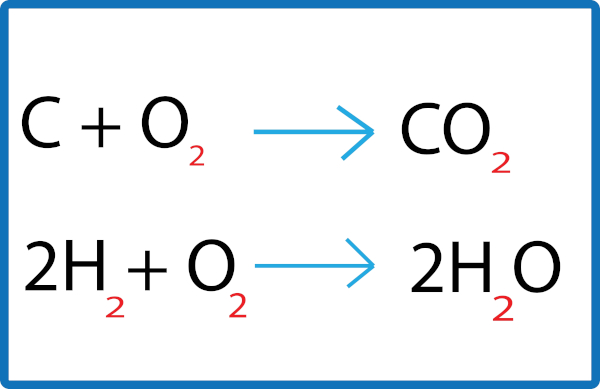
O balanceamento químico é uma técnica realizada nas equações químicas para que estas possam obedecer às leis das reações químicas, como a lei da conservação de massa, além da conservação de carga. Em um balanceamento químico, devemos igualar a quantidade de átomos participantes em ambos os lados da reação por meio da alteração de seus coeficientes estequiométricos.
O balanceamento químico pode ser realizado basicamente de duas formas: por tentativas sucessivas, o chamado método das tentativas, ou pelo balanceamento redox, que foca na eletroneutralidade da reação. Existem macetes para realizar balanceamentos, como a regra do MACHO, embora nem sempre seja possível encaixá-los.
Leia também: Como ocorre uma reação química?
Resumo sobre balanceamento químico
-
O balanceamento químico é uma técnica que busca adequar uma equação química às leis das reações químicas.
-
Uma equação química deve demonstrar que há conservação de massa e de carga.
-
O balanceamento químico busca igualar as quantidades de participantes em ambos os lados da equação.
-
É possível fazer o balanceamento químico pelo método das tentativas ou por oxirredução.
-
Existem macetes para realização do balanceamento, como a famosa regra do MACHO.
Videoaula sobre balanceamento químico
Como fazer o balanceamento químico?
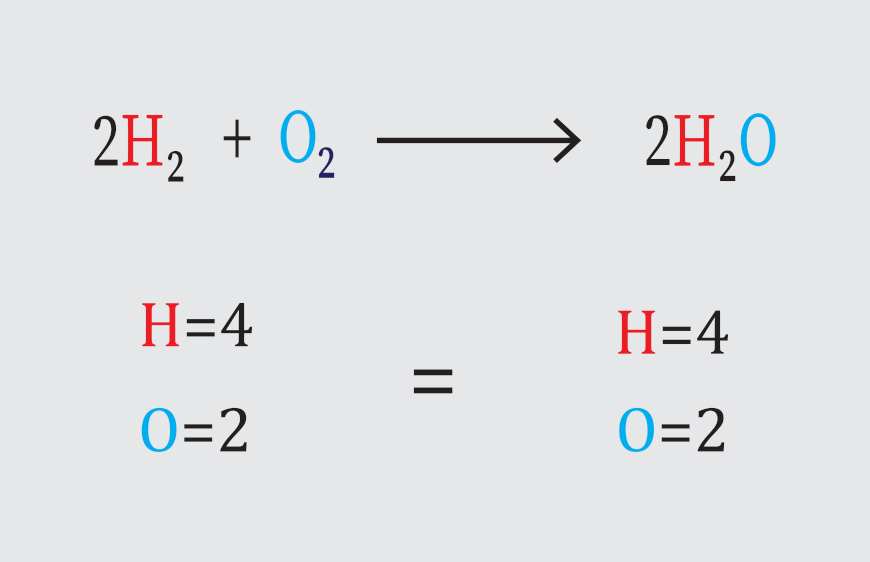
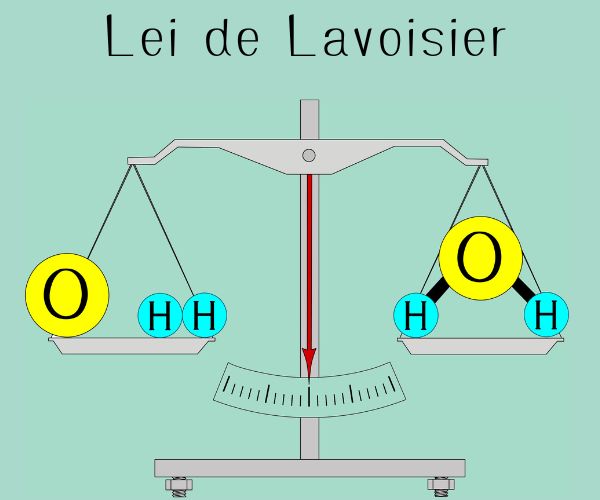
O balanceamento químico é uma técnica realizada em equações químicas para que estas obedeçam ao princípio da conservação de massa (lei de Lavoisier) e à conservação de carga. O objetivo é equalizar os participantes da reação alterando os coeficientes estequiométricos de cada participante, fazendo com que o número de elementos seja o mesmo em ambos os lados da equação.
Quais as regras para o balanceamento químico?
Para que o balanceamento químico ocorra adequadamente, duas regras devem ser respeitadas:
-
A quantidade dos átomos dos elementos participantes deve ser a mesma nos dois lados da equação química.
-
O somatório das cargas elétricas deve ser o mesmo em ambos os lados da equação química.
Essas duas regras respeitam a dois princípios básicos dos processos químicos, em que se deve haver conservação de massa, como estabelece a lei de Lavoisier, e a conservação de carga.
Veja também: O que é a constante de Avogrado?
Quais são os métodos de balanceamento químico?
Para se fazer o balanceamento, existem dois métodos adotados:
-
o chamado método das tentativas, que se centra na conservação de massa; e
-
o balanceamento redox, que se centra na conservação de cargas.
O método das tentativas, como o próprio nome diz, objetiva o balanceamento da equação química por meio da alteração aleatória dos coeficientes estequiométricos até que as quantidades dos participantes sejam iguais em ambos os lados da equação, ou seja, deve-se tentar diversos números para os coeficientes até que, de fato, a equação se encontre balanceada. Obviamente, esse processo pode parecer complexo, mas existem sugestões de realização do método das tentativas, sendo a regra do MACHO a principal delas.
Já o balanceamento redox se aproveita da observação de um processo de oxirredução que esteja ocorrendo. Nesse caso, avalia-se as cargas dos elementos envolvidos no processo, bem como o número de elétrons que transita entre os átomos, assim alterando os coeficientes estequiométricos de modo a se preservar a conservação de carga.
Macetes para fazer o balanceamento químico
-
Regra do MACHO
A regra do MACHO busca sistematizar a alteração dos coeficientes estequiométricos pelo método das tentativas. É um acrônimo em que cada letra indica o tipo de elemento a ser balanceado, na devida ordem:
Metal, Ametal, Carbono, Hidrogênio e, por fim, Oxigênio.
Vejamos na prática como realizar essa regra ao fazermos o balanceamento da reação que se segue:
HNO3 + Al2(CO3)3 → Al(NO3)3 + H2CO3
Avaliando a equação química, percebemos que há o alumínio, Al, um elemento metálico. Do lado dos produtos, há apenas um átomo de alumínio contabilizado, no Al(NO3)3, enquanto nos reagentes há dois átomos de alumínio contabilizados, no Al2(CO3)3. Dessa forma, para acertar a quantidade de átomos de alumínio, coloca-se o coeficiente estequiométrico 2 para o Al(NO3)3, o que multiplica a quantidade de alumínio por 2.
HNO3 + Al2(CO3)3 → 2 Al(NO3)3 + H2CO3
Seguindo, é o momento de se acertar o ametal. O carbono, de fato, é um ametal, assim como o hidrogênio e o oxigênio; porém esses elementos têm seu momento específico de serem balanceados pela regra. Por isso, o próximo elemento a ser balanceado é o ametal nitrogênio.
Percebe-se que existem seis átomos de nitrogênio no nitrato de alumínio, Al(NO3)3, uma vez que o coeficiente 2 — colocado por causa do alumínio — acaba multiplicando as quantidades de todos os elementos presentes na substância. Em contrapartida, há apenas um átomo de nitrogênio no composto HNO3. Por isso, deve-se colocar um coeficiente 6 na frente do HNO3, multiplicando a quantidade de nitrogênio ali presente por 6.
6 HNO3 + Al2(CO3)3 → 2 Al(NO3)3 + H2CO3
Seguindo a regra do MACHO, deve-se agora fazer o balanceamento do carbono. A avaliação desse elemento mostra que há três átomos de carbono no Al2(CO3)3, enquanto há um átomo de carbono no H2CO3. Assim sendo, coloca-se o coeficiente 3 na frente do H2CO3, multiplicando a quantidade de carbono ali presente por 3.
6 HNO3 + Al2(CO3)3 → 2 Al(NO3)3 + 3 H2CO3
Passando para o hidrogênio, vê-se que o coeficiente 6 colocado na frente do HNO3 fez com que sejam contabilizados seis átomos de hidrogênio nos reagentes. O coeficiente 3 colocado na frente do H2CO3 fez com que também sejam contabilizados seis átomos de hidrogênio. Por isso, como as quantidades de hidrogênio são iguais em ambos os lados da equação, pode-se dizer que tal elemento já está balanceado e nada deve ser feito.
Por fim, vê-se a questão do átomo de oxigênio, porém, na maioria das vezes, o átomo de oxigênio já se encontrará balanceado, exigindo apenas uma mera consulta. Nesse caso, repara-se que há, nos reagentes, 27 átomos de oxigênio em cada lado. No caso dos reagentes, 18 estão no HNO3 (por conta do coeficiente 6 na frente) e mais 9 estão no Al2(CO3)3. Já nos produtos, 18 estão no Al(NO3)3 (por conta do coeficiente 2 na frente) e mais 9 estão no H2CO3 (por conta do coeficiente 3 na frente).
-
Balanceamento redox
Vamos agora realizar um balanceamento redox (ou por oxirredução). Tal método é mais empregado quando a regra do MACHO ou outro jeito de se realizar o método das tentativas se torna bastante complexo. Observe a reação a seguir.
CS2 + H2S + Cu → Cu2S + CH4
A primeira coisa a se fazer é calcular o número de oxidação de todos os átomos. Depois, deve-se perceber quais elementos tiveram seu número de oxidação ao longo da reação, ou seja, quais têm número de oxidação diferente quando comparado entre reagentes e produtos. É o caso do carbono, que inicia com NOx = +4 no CS2 e termina com NOx = −4 no CH4. O mesmo ocorre com o cobre, que inicia com NOx = 0 nos reagentes e termina com NOx = +1 no Cu2S.
Dessa forma, pode-se entender que o carbono sofreu redução, pois teve diminuição do seu Nox, e o cobre sofreu oxidação, já que seu NOx aumentou. Entende-se que a variação da carga é consequência do trânsito de elétrons. Assim:
C4+ → C4−; significa que o carbono ganhou 8 elétrons.
Cu0 → Cu1+; significa que o cobre perdeu 1 elétron.
Contudo, o número de elétrons deve estar equalizado. Como no carbono há o ganho de 8 elétrons, multiplica-se o número de cobre por 8 na equação de modo que o número de elétrons ganhos, ao todo, também seja 8.
CS2 + H2S + 8 Cu → 8 Cu2S + CH4
Agora que a parte dos elétrons já está feita corretamente, os demais elementos devem ser balanceados pelo método das tentativas. Assim:
2 CS2 + 4 H2S + 8 Cu → 8 Cu2S + 2 CH4
Saiba mais: Massa molar e número de mol — qual a diferença?
Exercícios resolvidos sobre balanceamento químico
Questão 1. (Ufam PSI-CG/2024) Considere a seguinte equação redox que ocorre em solução aquosa:
KMnO4 + KCℓ + H2SO4 → MnSO4 + K2SO4 + H2O + Cℓ2
O coeficiente estequiométrico do cloro (Cℓ2), quando a equação está balanceada com os menores coeficientes de números inteiros, é:
(A) 1
(B) 3
(C) 8
(D) 5
(E) 10
Resposta: Letra D.
A análise da equação mostra que as espécies que variaram o número de oxidação são o Mn, que foi de +7 para +2, e o cloro, que foi de −1 para 0. No entanto, a espécie de cloro na reação é o Cl2, e, para que tudo dê certo, deve-se equalizar a quantidade de cloro antes colocando um coficiente 2 no KCl.
KMnO4 + 2 KCℓ + H2SO4 → MnSO4 + K2SO4 + H2O + Cℓ2
Assim:
Mn7+ → Mn2+; perda de 5 elétrons
2 Cl− → Cl20; ganho total de 2 elétrons
Fazendo o MMC, as espécies de manganês devem receber o coeficiente 2, enquanto as espécies de cloro devem receber o coeficiente 5.
2 KMnO4 + 10 KCℓ + H2SO4 → 2 MnSO4 + K2SO4 + H2O + 5 Cℓ2
Completando o balanceamento pelo método das tentativas, temos:
2 KMnO4 + 10 KCℓ + 8 H2SO4 → 2 MnSO4 + 6 K2SO4 + 8 H2O + 5 Cℓ2
Questão 2. (Unioeste Tarde/2024) O ouro em nível elevado de pureza é utilizado na produção de chips de computador. Um processo de refino do ouro em que ele reage com cloro em meio ácido é mostrado na equação a seguir.
Faça o balanceamento dessa equação de modo a determinar os coeficientes estequiométricos abaixo e assinale a alternativa que apresenta a sequência CORRETA dos mesmos.
x Au + y Cl2 + z HCl → w HAuCl4
(A) x = 1; y = 2; z = 2; w = 1.
(B) x = 2; y = 1; z = 2; w = 2.
(C) x = 2; y = 2; z = 3; w = 2.
(D) x = 2; y = 3; z = 3; w = 2.
(E) x = 2; y = 3; z = 2; w = 2.
Resposta: Letra E
Tal reação é passível de ser balanceada pelo método das tentativas. Iniciando pelo ouro, Au, vemos que as quantidades estão iguais em ambos os lados. Por isso, vamos manter o coeficiente “x” igual a 1. Já no cloro, percebe-se há quatro átomos do lado dos produtos, enquanto há 3 no lado dos reagentes: 2 no Cl2 e mais 1 no HCl. Como 4 é um número par, vamos alterar o coeficiente “z” para 2 de modo que a somatória de cloros fique igual a 4.
Au + y Cl2 + 2 HCl → w HAuCl4
Porém, ao fazermos isso, passamos a ter 2 átomos de hidrogênio nos reagentes, enquanto só há um único hidrogênio, forçando-nos a alterar o coeficiente “w” para 2.
Au + y Cl2 + 2 HCl → 2 HAuCl4
No entanto, ao fazermos isso, a quantidade de átomos de cloro passa a ser 8, uma vez que estamos falando do HAuCl4. Para não alterarmos mais a quantidade de átomos de hidrogênio e ouro, vamos alterar o coeficiente “y”, que só afeta o cloro, para 3, de modo que agora temos 8 átomos de cloro também nos reagentes.
Au + 3 Cl2 + 2 HCl → 2 HAuCl4
Por fim, devemos alterar o coeficiente do ouro de 1 para 2, pois o coeficiente 2 na frente do HAuCl4 o alterou.
2 Au + 3 Cl2 + 2 HCl → 2 HAuCl4
Pronto, agora a reação está devidamente balanceada, com x = 2, y = 3, z = 2 e w = 2.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. GoldBook – Compendium of Chemical Terminology. Disponível em: https://goldbook.iupac.org/